Apa perbedaan antara katalis dan menengah
Itu Perbedaan utama antara katalis dan menengah adalah bahwa katalis berguna pada awal reaksi dan diregenerasi pada akhirnya, sedangkan perantara terbentuk selama reaksi kimia dan tidak ada pada akhir reaksi.
Istilah Katalis dan Menengah sangat penting dalam reaksi kimia. Katalis adalah senyawa kimia yang dapat meningkatkan laju reaksi tanpa sendiri dikonsumsi, sedangkan perantara adalah molekul yang terbentuk dari dua atau lebih reaktan dan mengalami reaksi lebih lanjut untuk memberikan produk akhir.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu katalisator
3. Apa itu perantara
4. Catalyst vs Intermediate dalam bentuk tabel
5. Ringkasan -Catalyst vs Intermediate
Apa itu katalisator?
Katalis adalah senyawa kimia yang dapat meningkatkan laju reaksi tanpa dengan sendirinya dikonsumsi. Oleh karena itu, senyawa ini dapat terus bertindak berulang kali. Karena alasan ini, hanya sejumlah kecil katalis yang diperlukan untuk reaksi kimia tertentu.
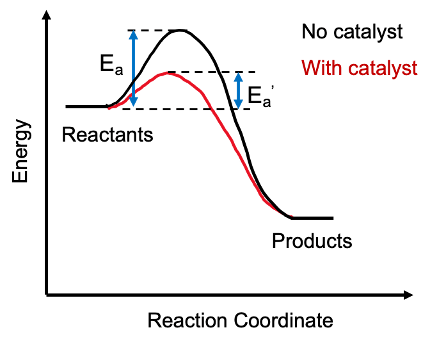
Katalis menyediakan jalur alternatif untuk reaksi kimia dengan mengurangi energi aktivasi suatu reaksi. Di sini, katalis bergabung dengan reaktan untuk membuat produk perantara, dan setelah selesainya reaksi yang diperlukan, katalis meninggalkan perantara dan regenerasi.
Ada dua jenis katalis; Mereka adalah katalis homogen dan heterogen. Dalam katalis homogen, molekul berada dalam fase yang sama dengan molekul reaktan. Namun, dalam katalis heterogen, molekul berada dalam fase yang berbeda dengan molekul reaktan. Enzim adalah contoh yang baik dari katalis biologis.
Apa itu perantara?
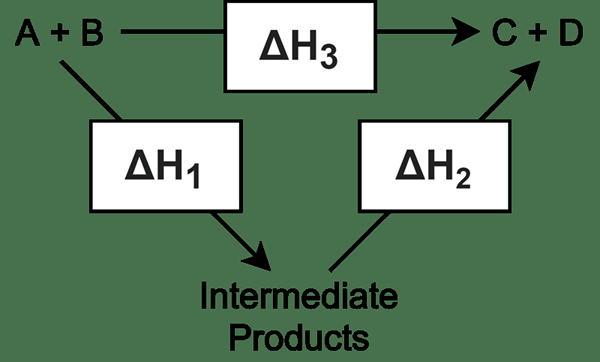
Intermediate adalah molekul yang terbentuk dari dua atau lebih reaktan dan mengalami reaksi lebih lanjut untuk memberikan produk akhir. Intermediate terbentuk dalam reaksi beberapa langkah. Sebagian besar waktu, reaksi kimia yang rumit membutuhkan lebih dari satu langkah untuk menyelesaikan reaksi untuk mendapatkan produk akhir yang diinginkan. Dalam reaksi ini, semua langkah reaksi selain langkah terakhir memberikan perantara; Langkah terakhir memberikan produk daripada memberikan perantara. Oleh karena itu, perantara tidak stabil, dan cenderung mengalami reaksi lebih lanjut dengan cepat.

Biasanya, perantara terjadi dalam campuran reaksi sangat jarang karena sifatnya yang tidak stabil. Mereka ada untuk waktu yang singkat. Selain itu, sangat sulit untuk mengisolasi perantara karena cenderung bereaksi lebih lanjut. Dalam reaksi tertentu, mungkin ada jumlah molekul menengah yang sangat tinggi di setiap langkah reaksi. Terkadang, sangat sulit untuk mengidentifikasi molekul -molekul ini.
Kita dapat membedakan antara intermediet dan getaran molekuler. Ini biasanya memiliki masa hidup yang sama dan hanyalah transisi. Biasanya, molekul ini sangat reaktif. Contoh yang baik adalah esterifikasi diol, di mana monoester diproduksi pada langkah pertama, dan dioester terbentuk pada langkah kedua (final).
Apa perbedaan antara katalis dan menengah?
Perbedaan utama antara katalis dan menengah adalah bahwa katalis berguna pada awal reaksi dan diregenerasi pada akhir, sedangkan perantara terbentuk selama reaksi kimia dan tidak ada pada akhir reaksi reaksi. Selain itu, katalis stabil, sedangkan perantara sangat tidak stabil.
Infografis di bawah ini menyajikan perbedaan antara katalis dan menengah dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -Catalyst vs Intermediate
Perbedaan utama antara katalis dan menengah adalah bahwa katalis ditambahkan pada awal reaksi dan diregenerasi pada akhir reaksi sedangkan perantara terbentuk selama reaksi dan tidak diregenerasi pada akhir reaksi.
Referensi:
1. Helmenstine, Anne Marie, PH.D. “Apa itu reaksi menengah?"Thoughtco, Aug. 27, 2020.
Gambar milik:
1. "Catalyst Energy Diagram" oleh Emma Ambrogi - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. "Hess Cycle Diagram" oleh SGDWN - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


