Apa perbedaan antara reaksi dasar dan kompleks
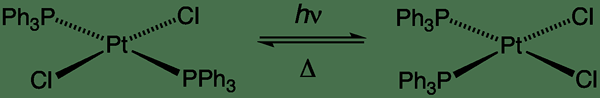
Itu Perbedaan utama antara reaksi dasar dan kompleks Apakah reaksi dasar pada dasarnya memiliki satu langkah, sedangkan reaksi kompleks pada dasarnya memiliki beberapa langkah.
Kita dapat mengkategorikan reaksi kimia dengan cara yang berbeda. Tetapi ada dua kategorisasi dasar sebagai reaksi dasar dan reaksi kompleks. Reaksi dasar hanya mencakup sub-langkah tunggal, sedangkan reaksi kompleks memiliki serangkaian langkah dan keadaan transisi yang berbeda dengan perantara yang berbeda.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu reaksi dasar
3. Apa reaksi yang kompleks
4. Reaksi dasar vs kompleks dalam bentuk tabel
5. Ringkasan - Reaksi Dasar Vs Kompleks
Apa itu reaksi dasar?
Reaksi dasar dapat didefinisikan sebagai reaksi kimia yang mencakup sub-langkah tunggal. Dalam reaksi ini, satu spesies kimia mengalami perubahan langsung untuk memberikan produk akhir dalam satu langkah. Di sini, keadaan transisi tunggal diamati. Jika kami tidak dapat secara eksperimental mendeteksi produk perantara selama reaksi kimia, kami dapat mengkategorikan reaksi itu sebagai reaksi dasar.
Jenis Reaksi Dasar
Ada beberapa jenis reaksi dasar sebagai berikut:
- Reaksi unimolekul
Dalam reaksi unimolekul, reaktan tunggal mengalami reaksi seperti dekomposisi untuk memberikan produk akhir (s). Beberapa contoh reaksi unimolekul termasuk isomerisasi CIS-Trans, racemization, pembukaan cincin, peluruhan radioaktif, dll.
Gambar 01: Jenis isomerisasi CIS-Trans
- Reaksi bimolekul
Dalam reaksi bimolekul, dua partikel mengalami tabrakan untuk memberikan produk (s). Ini adalah reaksi orde kedua karena laju reaksi tergantung pada kedua reaktan. Reaksi substitusi nukleofilik adalah contohnya.
- Reaksi trimolekul
Dalam reaksi trimolekul, tiga partikel mengalami tabrakan pada saat yang sama untuk memberikan produk (s). Namun, jenis reaksi ini jarang terjadi karena sulit bagi tiga reaktan untuk bertabrakan pada saat yang sama.
Apa reaksi yang kompleks?
Reaksi kompleks dapat didefinisikan sebagai reaksi kimia yang mencakup beberapa sub-langkah. Dengan kata lain, reaksi ini memiliki serangkaian langkah serta keadaan transisi yang berbeda dengan perantara yang berbeda. Oleh karena itu, reaksi ini sangat kompleks.
Tidak seperti dalam reaksi dasar, urutan reaksi tidak setuju dengan koefisien stoikiometrik dari reaksi. Selain itu, urutan reaksi ini dapat berupa bilangan bulat atau pecahan.
Contoh umum dari jenis reaksi ini adalah dekomposisi hidrogen peroksida, di mana ada dua langkah berbeda dari mana kita dapat memperoleh reaksi dekomposisi keseluruhan.
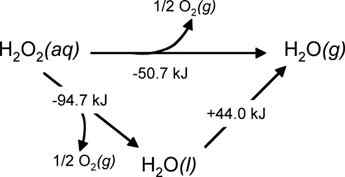
Gambar 02: Dekomposisi hidrogen peroksida
Jenis Reaksi Kompleks
Ada tiga jenis utama reaksi kompleks:
- Reaksi berurutan
Jenis reaksi ini mencakup serangkaian reaksi ireversibel orde pertama.
- Reaksi paralel
Reaksi paralel mencakup beberapa langkah mengenai reaksi bersih yang sama, dan reaksi bertahap terjadi paralel satu sama lain secara bersamaan.
- Reaksi reversibel
Reaksi reversibel adalah reaksi kimia di mana reaktan membentuk produk yang bereaksi bersama, membentuk reaktan kembali, yang melibatkan setidaknya dua langkah reaksi dasar untuk memberikan reaksi bersih yang sama.
Apa perbedaan antara reaksi dasar dan kompleks?
Perbedaan utama antara reaksi dasar dan kompleks adalah bahwa reaksi dasar pada dasarnya memiliki satu langkah, sedangkan reaksi kompleks pada dasarnya memiliki beberapa langkah. Selain itu, reaksi dasar secara langsung membentuk produk, sedangkan reaksi kompleks membentuk satu atau lebih perantara sebelum memberikan produk akhir.
Infografis di bawah ini menyajikan perbedaan antara reaksi dasar dan kompleks dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -Reaksi Dasar Vs Kompleks
Kita dapat membagi reaksi kimia menjadi berbagai jenis. Tetapi ada dua kategorisasi dasar sebagai reaksi dasar dan reaksi kompleks. Perbedaan utama antara reaksi dasar dan kompleks adalah bahwa reaksi dasar pada dasarnya memiliki satu langkah, sedangkan reaksi kompleks pada dasarnya memiliki beberapa langkah.
Referensi:
1. “9.4: Reaksi yang lebih kompleks." Libreteks Kimia, Libretexts, 14 Juli 2020.
Gambar milik:
1. “CIS-Trans-ptcl2p2” oleh Smokefoot-Karya Sendiri (CC BY-SA 4.0) Via Commons Wikimedia
2. "Prinsip Kimia Fig2-5" oleh Charles A. Wight - Own Work (CC By 3.0) Via Commons Wikimedia


