Apa perbedaan antara katalisis basa asam umum dan spesifik
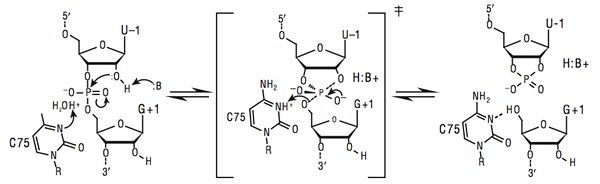
Itu Perbedaan utama antara katalisis basa asam umum dan spesifik adalah bahwa katalisis asam-basa umum terjadi pada pH konstan tetapi konsentrasi buffer yang berbeda, sedangkan katalisis basa asam spesifik tidak tergantung pada konsentrasi buffer dan tergantung pada kandungan ion hidronium.
Katalisis dapat digambarkan sebagai proses di mana laju dan hasil reaksi dapat dipengaruhi oleh keberadaan zat yang tidak dikonsumsi selama reaksi. Selanjutnya, zat ini dihilangkan dari campuran reaksi. Ada dua jenis katalisis asam-basa, yang dikenal sebagai katalisis umum dan katalisis spesifik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu katalisis basa asam umum
3. Apa itu katalisis basa asam spesifik
4. Katalisis basa asam umum vs spesifik dalam bentuk tabel
5. Ringkasan -Katalisis basa asam umum vs spesifik
Apa itu katalisis basa asam umum?
Katalisis asam-basa umum adalah jenis katalisis yang terjadi ketika residu asam atau basa di lokasi aktif berguna dalam memfasilitasi transfer proton dalam reaksi. Jenis katalisis ini penting untuk spesifisitas dan peningkatan laju. Asam atau basa umum mengacu pada residu asam amino dalam hidrolase glikosida atau enzim terkait yang dapat berpartisipasi dalam mekanisme hidrolisis melalui menghilangkan atau menambahkan proton. Mekanisme ini merupakan mekanisme penahan atau pembalikan.

Apa itu katalisis basa asam spesifik?
Katalisis asam-basa spesifik adalah proses di mana laju reaksi tergantung pada basa spesifik dan bukan pada basa lain dalam larutan. Dengan kata lain, katalisis terjadi dengan ion hidronium atau hidroksida, dan hanya dapat ditentukan oleh pH, bukan konsentrasi buffer.
Sebagai contoh, hidrolisis etil asetat adalah reaksi asam-basa spesifik. Ini adalah reaksi yang sangat lambat pada pH netral karena baik nukleofil dan elektrofil tidak reaktif. Selain itu, laju reaksi dapat dipercepat, atau reaktivitas nukleofil atau elektrofil dapat ditingkatkan. Karena peningkatan pH dapat meningkatkan konsentrasi ion hidroksida (ion hidroksida adalah nukleofil yang lebih baik dibandingkan dengan air), laju hidrolisis pada pH dapat meningkat. Di sisi lain, penurunan pH dapat meningkatkan konsentrasi ion hidronium yang mampu memprotonasi karbonil ester, yang pada gilirannya dapat meningkatkan elektrofilisitas, sehingga meningkatkan laju hidrolisis.
Apa perbedaan antara katalisis basa asam umum dan spesifik?
Perbedaan utama antara katalisis basa asam umum dan spesifik adalah bahwa katalisis asam-basa umum terjadi pada pH konstan tetapi konsentrasi buffer yang berbeda, sedangkan katalisis basa asam spesifik tidak tergantung pada konsentrasi buffer dan tergantung pada kandungan ion hidronium. Selain itu, dalam katalisis basa asam umum, pelarut tidak bertindak sebagai asam atau basa, sedangkan dalam katalisis basa asam tertentu, pelarut bertindak sebagai asam atau basa.
Tabel berikut merangkum perbedaan antara katalisis basa asam umum dan spesifik.
Ringkasan -Katalisis basa asam umum vs spesifik
Katalisis asam-basa umum adalah jenis katalisis yang terjadi ketika residu asam atau basa di lokasi aktif berguna dalam memfasilitasi transfer proton dalam reaksi. Katalisis asam-basa spesifik adalah proses di mana laju reaksi tergantung pada basa spesifik dan bukan pada basa lain dalam larutan. Perbedaan utama antara katalisis basa asam umum dan spesifik adalah bahwa katalisis asam-basa umum terjadi pada pH konstan tetapi konsentrasi buffer yang berbeda, sedangkan katalisis basa asam spesifik tidak tergantung pada konsentrasi buffer dan tergantung pada kandungan ion hidronium.
Referensi:
1. “A1. Asam umum dan katalisis basa." Libreteks Kimia, Libretexts, 11 Agustus. 2020.
Gambar milik:
1. “Katalisis Basa Asam” oleh Noxwei - Karya Sendiri (CC BY -SA 3.0) Via Commons Wikimedia


