Apa perbedaan antara asam protik dan asam Lewis
Itu Perbedaan utama antara asam protik dan asam Lewis adalah bahwa asam protik adalah donor proton, sedangkan asam lewis adalah akseptor proton.
Asam protik adalah senyawa kimia yang dapat menghasilkan proton atau ion hidronium dalam larutannya dengan melepaskan proton. Asam Lewis adalah senyawa kimia yang dapat menerima pasangan elektron dari spesies kimia yang donasi elektron.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam protik
3. Apa itu asam Lewis
4. Asam protat vs asam lewis dalam bentuk tabel
5. Ringkasan - Asam Asam Protat vs Lewis
Apa itu asam protik?
Asam protik adalah senyawa kimia yang dapat menghasilkan proton atau ion hidronium dengan melepaskan proton. Pelepasan proton ini terjadi karena asam ini dapat menerima sepasang elektron dari ohon dalam air dengan bertindak sebagai asam Lewis, tetapi tidak dapat menghasilkan ion hidronium atau proton dengan sendirinya.
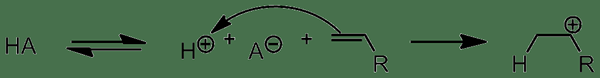
Gambar 01: Aksi asam protik
Ada tiga jenis asam protik utama sebagai asam monoprotik, asam poliprotik, dan asam diprotik . Asam monoprotik dapat melepaskan satu proton ke larutan, sedangkan asam diprotik dapat melepaskan dua proton. Di sisi lain, asam poliprotik dapat melepaskan lebih dari dua proton. Dalam asam poliprotik, proton dilepaskan dalam beberapa langkah. Namun, proton pertama hilang dari asam lebih mudah daripada proton berikutnya.
Apa itu asam Lewis?
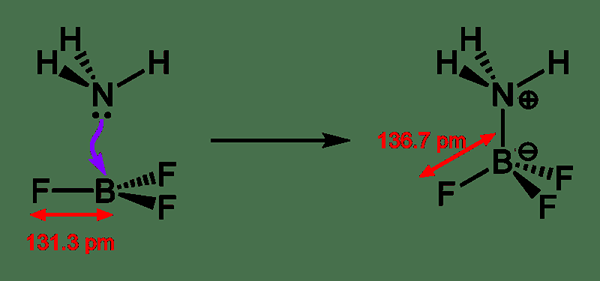
Asam Lewis adalah senyawa kimia yang dapat menerima pasangan elektron dari spesies kimia yang donasi elektron. Jenis senyawa asam ini mengandung orbital kosong yang mampu menerima pasangan elektron dari basa Lewis, membentuk adduct lewis. Sebaliknya, basis Lewis adalah spesies kimia yang memiliki orbital terisi yang terdiri dari pasangan elektron. Pasangan elektron ini tidak berpartisipasi dalam ikatan, tetapi dapat membentuk ikatan datif dengan asam Lewis untuk membentuk adduct lewis.

Gambar 02: Pembentukan adduct Lewis
Biasanya, istilah asam Lewis hanya digunakan dengan senyawa kimia planar trigonal yang mengandung orbital P kosong. Di sana, kita dapat memperlakukan senyawa kompleks bahkan seperti Et3al2Cl3 sebagai senyawa planar trigonal yang dapat dinamai asam Lewis. Terlepas dari pembentukan adduksi Lewis, reaksi lain yang melibatkan asam Lewis dikenal sebagai reaksi yang dikatalisis asam. Terkadang, kami menemukan senyawa kimia seperti H2O yang memiliki sifat asam Lewis dan Lewis. Ini karena senyawa ini dapat menyumbangkan atau menerima pasangan elektron, tergantung pada reaksi kimia di mana mereka terlibat.
Ada berbagai asam Lewis. Asam Lewis paling sederhana cenderung bereaksi dengan mudah dan langsung dengan basa Lewis. Asam Lewis yang paling umum cenderung menjalani reaksi kimia sebelum pembentukan aduk. Beberapa contoh untuk asam Lewis termasuk ion onium seperti ion amonium dan ion hidronium, kation logam seperti ion besi, spesies planar trigonal seperti BF3, sistem PI miskin elektron seperti enon, dll. Tiga jenis utama asam Lewis termasuk asam Lewis sederhana, asam lewis kompleks dan asam h+ lewis. Aplikasi asam Lewis yang paling umum adalah alkilasi kerajinan friedel.
Apa perbedaan antara asam protik dan asam Lewis?
Kita dapat membedakan asam protik dari asam Lewis melalui aksi pelepasan proton dari senyawa asam. Perbedaan utama antara asam protik dan asam Lewis adalah bahwa asam protat adalah donor proton, sedangkan asam Lewis adalah akseptor proton.
Infografis berikut ini menyajikan perbedaan antara asam protik dan asam Lewis dalam bentuk tabel.
Ringkasan -Asam Asam Protat vs Lewis
Sebagai kesimpulan, asam protik berbeda dari asam Lewis tergantung pada kemampuan senyawa ini untuk melepaskan proton ke larutan. Perbedaan utama antara asam protik dan asam Lewis adalah bahwa asam protat adalah donor proton, sedangkan asam Lewis adalah akseptor proton.
Referensi:
1. “Asam dan basa poliprotik." Libreteks Kimia, Libretexts, 15 Agustus. 2020.
Gambar milik:
1. “Inisiasi Asam Protat” oleh Matchem121 - Karya Sendiri (CC oleh 3.0) Via Commons Wikimedia
2. "NH3-BF3-ADDUCT-BOND-LINGENING-2D" oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia


