Apa perbedaan antara sel volta dan sel elektrolitik
Perbedaan utama antara sel volta dan sel elektrolitik adalah bahwa sel volta menggunakan energi yang dilepaskan selama reaksi redoks spontan untuk menghasilkan listrik, sedangkan sel elektrolitik menggunakan energi listrik dari sumber eksternal untuk memaksa reaksi terjadi.
Sel volta atau sel galvanik dan sel elektrolitik adalah dua istilah penting dalam elektrokimia. Elektrokimia dapat digambarkan sebagai studi tentang hubungan antara reaksi listrik dan kimia. Ada dua jenis sel elektrokimia; Mereka adalah sel volta dan sel elektrolitik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu sel volta
3. Apa itu sel elektrolitik
4. Sel volta vs sel elektrolitik dalam bentuk tabel
5. Ringkasan -Sel Volta Vs Sel Elektrolitik
Apa itu sel volta?
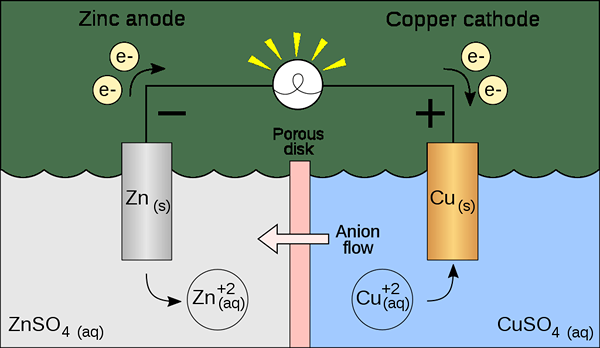
Sel volta adalah jenis sel elektrokimia yang menggunakan reaksi redoks spontan untuk menghasilkan energi listrik. Itu juga dikenal sebagai a sel galvanik. Sel mengandung dua sel setengah yang dapat berupa komposisi yang sama atau komposisi yang berbeda. Setiap setengah sel berisi elektroda dan elektrolit. Elektroda harus direndam dalam larutan elektrolitik. Terkadang, elektrolit ini benar -benar terpisah, tetapi di waktu lain, mereka hanya dipisahkan oleh penghalang berpori. Ketika elektrolit benar -benar terpisah, kita perlu menggunakan jembatan garam untuk mempertahankan pergerakan ion antara dua elektrolit.

Gambar 01: Sel Volta
Dalam mempersiapkan sel ini, kita perlu mempertimbangkan apakah elektroda dan elektrolit spontan atau tidak. Kita dapat menemukannya secara teoritis dengan menghitung potensi elektroda dari setiap sel setengah. Namun, satu sel setengah harus menunjukkan oksidasi, sedangkan setengah sel lainnya harus menunjukkan reaksi reduksi. Oksidasi terjadi pada anoda, sedangkan reduksi terjadi di katoda. Karena sel galvanik (Volta) menggunakan energi yang dilepaskan selama reaksi redoks spontan untuk menghasilkan listrik, sel galvanik penting sebagai sumber energi listrik. Mereka menghasilkan arus searah.
Apa itu sel elektrolitik?
Sel elektrolitik adalah perangkat di mana energi listrik dikonversi menjadi energi kimia atau sebaliknya. Jenis sel ini biasanya mengandung dua konduktor logam atau elektronik yang dipegang satu sama lain dan bersentuhan dengan elektrolit yang biasanya dilarutkan atau menyatu dalam senyawa ionik.
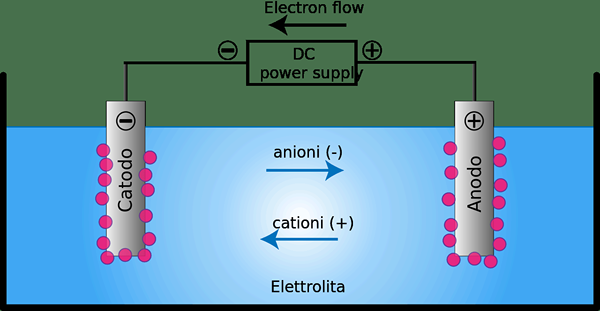
Gambar 02: Sel elektrolitik
Kita dapat menggunakan sel elektrolitik sebagai sel elektrokimia yang digunakan untuk membuat elektrolisis terjadi pada senyawa tertentu. Untuk e.G. Menghadapi air ke elektrolisis dapat membentuk oksigen gas dan hidrogen gas. Perangkat ini menggunakan arus listrik untuk mendorong reaksi redoks yang tidak disukai secara termodinamik. Selain itu, oksidasi terjadi di anoda, sementara reduksi terjadi di katoda.
Apa perbedaan antara sel volta dan sel elektrolitik?
Istilah sel volta (sel galvanik) dan sel elektrolitik sangat penting dalam produksi listrik. Perbedaan utama antara sel volta dan sel elektrolitik adalah bahwa sel volta menggunakan energi yang dilepaskan selama reaksi redoks spontan untuk menghasilkan listrik, sedangkan sel elektrolitik menggunakan energi listrik dari sumber eksternal untuk memaksa reaksi yang terjadi akan terjadi. Saat mempertimbangkan pelepasan energinya, sel-sel volta mendapatkan energi dari reaksi redoks spontan, sedangkan sel elektrolitik melibatkan reaksi non-spontan, dan oleh karena itu, memerlukan sumber elektron eksternal seperti baterai DC dari sumber daya AC AC.
Tabel berikut merangkum perbedaan antara sel volta dan sel elektrolitik.
Ringkasan -Sel Volta Vs Sel Elektrolitik
Sel volta dan sel elektrolitik adalah dua istilah penting dalam elektrokimia. Perbedaan utama antara sel volta dan sel elektrolitik adalah bahwa sel volta menggunakan energi yang dilepaskan selama reaksi redoks spontan untuk menghasilkan listrik, sedangkan sel elektrolitik menggunakan energi listrik dari sumber eksternal untuk memaksa reaksi yang terjadi akan terjadi.
Referensi:
1. “Elektrokimia (artikel)." Akademi Khan.
Gambar milik:
1. “Sel Galvanik With No Cation Flow” oleh Asli: Ohiostardard Vector: Anticompositenumber - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. "Muatan Sel Elektrolitik" oleh Rodez2 - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia


