Apa perbedaan antara momen polarizabilitas dan dipol
Itu Perbedaan utama antara momen polarizabilitas dan dipol Apakah polarisasi adalah ukuran seberapa mudah awan elektron terdistorsi oleh medan listrik, sedangkan momen dipol adalah pemisahan muatan positif dan negatif dalam suatu sistem.
Momen polarizabilitas dan dipol adalah dua istilah penting dalam kimia yang dijelaskan dalam kaitannya dengan atom, molekul, dan awan elektronnya.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu kemampuan polariz
3. Apa itu momen dipol
4. Momen polarizabilitas vs dipol dalam bentuk tabel
5. Ringkasan -momen polarizabilitas vs dipol
Apa itu kemampuan polariz?
Polarizability dapat digambarkan sebagai kecenderungan materi untuk memperoleh momen dipol listrik secara proporsional dengan medan yang diterapkan ketika medan listrik diterapkan. Fenomena ini adalah properti dari semua materi ketika kami menganggap hal itu dibangun dari partikel elementer yang memiliki muatan listrik melalui proton dan elektron.
Di hadapan medan listrik, elektron bermuatan negatif dan inti atom bermuatan positif mengalami efek gaya berlawanan dan pemisahan muatan. Polarizability bertanggung jawab atas konstanta dielektrik material dan indeks bias ketika frekuensi tinggi dipertimbangkan.
Selain itu, polarizabilitas atom atau molekul adalah rasio momen dipol yang diinduksi dan medan listrik lokal. Ketika padatan kristal dipertimbangkan, kita dapat mengidentifikasi momen dipol per unit sel. Selain itu, medan listrik lokal dapat diamati dengan molekul yang umumnya berbeda dari medan listrik makroskopik yang dapat kita ukur secara eksternal.
Demikian pula, polarisasi magnetik mengacu pada kecenderungan momen dipol magnetik untuk muncul secara proporsional dengan medan magnet eksternal. Polarizabilitas listrik dan polarisasi magnetik menentukan respons dinamis dari sistem terikat ke bidang eksternal dan memberikan wawasan tentang struktur internal molekul.
Apa itu momen dipol?
Momen dipol dapat digambarkan sebagai pemisahan muatan listrik. Pemisahan muatan dapat terjadi antara dua ion dalam ikatan ionik atau dua atom dalam ikatan kimia kovalen. Momen dipol muncul karena perbedaan antara nilai elektronegativitas dari atom yang berbeda yang membentuk ikatan kimia. Semakin besar perbedaan antara nilai elektronegativitas, semakin besar momen dipol. Momen dipol mengukur polaritas molekul. Momen dipol molekul dihitung menggunakan persamaan berikut.
μ = σq.R
μ adalah momen dipol, q adalah besarnya muatan, dan r adalah posisi muatan. Di sini, μ dan r adalah vektor, yang merupakan jumlah yang memiliki arah serta besarnya.

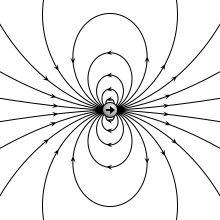
Gambar 01: Medan listrik dari dipol listrik
Namun kadang -kadang, istilah momen dipol digunakan untuk menyebutkan ukuran polaritas magnetik dari sistem tuduhan. Momen dipol magnetik menentukan torsi yang dialami magnet dalam medan magnet eksternal. (Torsi = momen; gaya rotasi).
Apa perbedaan antara momen polarizabilitas dan dipol?
Momen polarizabilitas dan dipol adalah dua istilah penting. Perbedaan utama antara momen polarizabilitas dan dipol adalah bahwa polarisasi adalah ukuran seberapa mudah awan elektron terdistorsi oleh medan listrik, sedangkan momen dipol adalah pemisahan muatan positif dan negatif dalam suatu sistem.
Tabel berikut merangkum perbedaan antara momen polarizabilitas dan dipol.
Ringkasan -momen polarizabilitas vs dipol
Polarizability adalah kecenderungan materi untuk memperoleh momen dipol listrik secara proporsional dengan medan yang diterapkan ketika medan listrik diterapkan, sedangkan momen dipol adalah pemisahan muatan listrik. Perbedaan utama antara momen polarizabilitas dan dipol adalah bahwa polarisasi adalah ukuran seberapa mudah awan elektron terdistorsi oleh medan listrik, sedangkan momen dipol adalah pemisahan muatan positif dan negatif dalam suatu sistem.
Referensi:
1. “Polarizability." Libreteks Kimia, Libretexts, 4 Mei 2022.
Gambar milik:
1. "VFPT Dipole Animation Electric" oleh Geek3 - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia


