Perbedaan antara alkali dan basis

Itu perbedaan utama antara alkali dan basis adalah bahwa Elemen Grup 1 dikategorikan sebagai elemen alkali sedangkan elemen atau senyawa yang memiliki sifat dasar dikategorikan sebagai basis.
Kami sering menggunakan kata alkali secara bergantian untuk mengatasi solusi yang sangat mendasar dan logam alkali. Dalam konteks ini, alkali dirujuk ke logam alkali dari kelompok 1 dari tabel elemen periodik. Namun, istilah basis dapat merujuk pada elemen, molekul, ion, dll apa pun. yang memiliki sifat dasar.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu alkali
3. Apa itu basis
4. Perbandingan berdampingan - alkali vs basis dalam bentuk tabel
5. Ringkasan
Apa itu alkali?
Alkali adalah istilah yang biasa kita gunakan untuk logam di kelompok 1 dari tabel periodik. Ini juga dikenal sebagai logam alkali. Meskipun H juga dalam kelompok ini, itu agak berbeda; itu memiliki perilaku yang berbeda dari anggota lain dari kelompok ini. Oleh karena itu, lithium (Li), natrium (Na), kalium (k), rubidium (rb), cesium (CS) dan francium (FR) adalah anggota kelompok ini.
Logam alkali lembut, mengkilap, logam warna keperakan. Mereka semua hanya memiliki satu elektron di cangkang luar mereka, dan mereka suka menghapus ini dan membentuk +1 kation. Saat luar sebagian besar elektron bersemangat, ia kembali ke keadaan dasar sambil memancarkan radiasi di kisaran yang terlihat. Emisi elektron ini mudah; Dengan demikian, logam alkali sangat reaktif. Selanjutnya, reaktivitas meningkat ke bawah kelompok 1 dari tabel periodik.

Gambar 01: Sodium hidroksida - hidroksida logam alkali
Logam ini membentuk senyawa ionik dengan atom elektronegatif lainnya. Lebih tepatnya, istilah alkali mengacu pada karbonat atau hidroksida logam alkali. Mereka juga memiliki sifat dasar. Mereka pahit dalam rasa, licin, dan bereaksi dengan asam, untuk menetralisirnya.
Apa itu basis?
Definisi
Berbagai ilmuwan mendefinisikan "basis" secara berbeda. Arrhenius mendefinisikannya sebagai zat yang menyumbang ohion untuk solusi. Bronsted- Lowry mendefinisikan basis sebagai zat yang dapat menerima proton. Menurut Lewis, donor elektron apa pun adalah basis. Menurut definisi Arrhenius, senyawa harus memiliki anion hidroksida dan kemampuan untuk menyumbangkannya sebagai ion hidroksida untuk menjadi basis. Namun, menurut Lewis dan Bronsted-Lowry, mungkin ada molekul, yang tidak memiliki hidroksida tetapi dapat bertindak sebagai basis. Misalnya, NH3 adalah basis Lewis, karena dapat menyumbangkan pasangan elektron pada nitrogen. Demikian juga, na2BERSAMA3 adalah basis bronsted-lowry tanpa grup hidroksida tetapi dapat menerima hidrogen.
Properti
Pangkalan memiliki sabun yang licin seperti perasaan dan rasa pahit. Mereka bereaksi dengan mudah dengan asam yang menghasilkan air dan molekul garam. Soda kaustik, amonia, dan soda kue adalah beberapa basis umum. Kami dapat mengkategorikan senyawa ini menjadi dua kelompok, tergantung pada kemampuannya untuk memisahkan dan menghasilkan ion hidroksida. Mereka adalah pangkalan yang kuat dan lemah. Basis yang kuat seperti NaOH, KOH, dapat sepenuhnya terionisasi dalam solusi, untuk memberikan ion. Basis lemah seperti NH3 sebagian memisahkan dan memberikan lebih sedikit ion hidroksida.

Gambar 02: Barium hidroksida - dasar elemen grup 2 Barium
Selanjutnya, kB adalah konstanta disosiasi dasar. Ini menunjukkan kemampuan untuk kehilangan ion hidroksida dari basis yang lemah. Untuk memeriksa apakah suatu zat adalah dasar atau tidak, kita dapat menggunakan beberapa indikator seperti kertas lakmus atau kertas pH. Senyawa ini menunjukkan nilai pH lebih tinggi dari 7, dan mengubah lakmus merah menjadi biru.
Apa perbedaan antara alkali dan basis?
Logam Grup 1 disebut sebagai alkali, atau lebih tepatnya, karbonat dan hidroksida mereka disebut sebagai alkali. Namun, mereka memiliki sifat dasar; Dengan demikian, mereka adalah bagian dari pangkalan. Perbedaan utama antara alkali dan basis adalah bahwa elemen Grup 1 dikategorikan sebagai elemen alkali sedangkan elemen atau senyawa yang memiliki sifat dasar dikategorikan sebagai basis. Oleh karena itu, semua alkali adalah pangkalan, tetapi tidak semua pangkalan adalah alkali. Perbedaan signifikan lainnya antara alkali dan basa adalah bahwa alkali membentuk garam ionik sedangkan basis tidak selalu demikian.
Infografis di bawah ini tentang perbedaan antara alkali dan basis menunjukkan perbedaan ini dalam bentuk tabel.
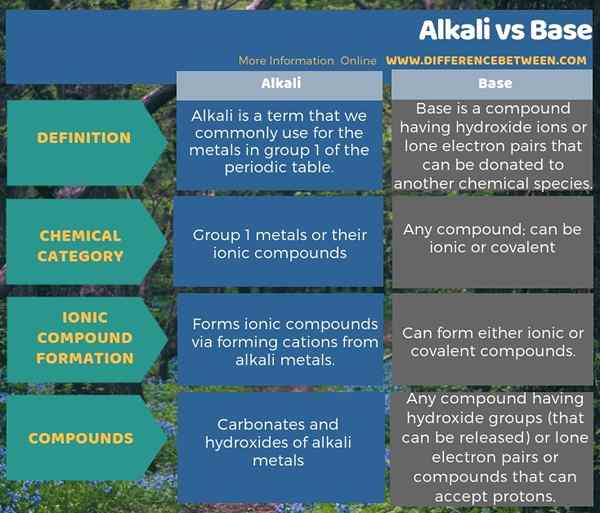
Ringkasan -Alkali vs Base
Kami sering menggunakan dua istilah alkali dan basis secara bergantian, tetapi mereka adalah dua istilah yang berbeda. Perbedaan utama antara alkali dan basis adalah bahwa elemen Grup 1 dikategorikan sebagai elemen alkali sedangkan elemen atau senyawa yang memiliki sifat dasar dikategorikan sebagai basis.
Referensi:
1. Britannica, editor Encyclopaedia. "Alkali.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 14 Jan. 2014. Tersedia disini
2. “Basis (Kimia).”Wikipedia, Wikimedia Foundation, 27 Nov. 2018. Tersedia disini
Gambar milik:
1."Sodium Hydroxide Image" oleh Walkerma - karya sendiri, (domain publik) via Commons Wikimedia
2."BA (OH) 2 Octahydrate" oleh Leiem - karya sendiri, (CC BY -SA 4.0) Via Commons Wikimedia


