Perbedaan antara alkana dan alkena
Perbedaan utama - Alkana vs alkena
Alkana dan alkena adalah dua jenis keluarga hidrokarbon yang mengandung karbon dan hidrogen dalam struktur molekulnya. Perbedaan utama antara alkana dan alkena adalah struktur kimianya; Alkana adalah hidrokarbon jenuh dengan formula molekul umum CNH2n+2 dan alkena dikatakan sebagai kelompok hidrokarbon yang tidak jenuh karena mengandung ikatan rangkap antara dua atom karbon. Mereka memiliki formula molekul umum CNH2n.
Apa itu alkana?
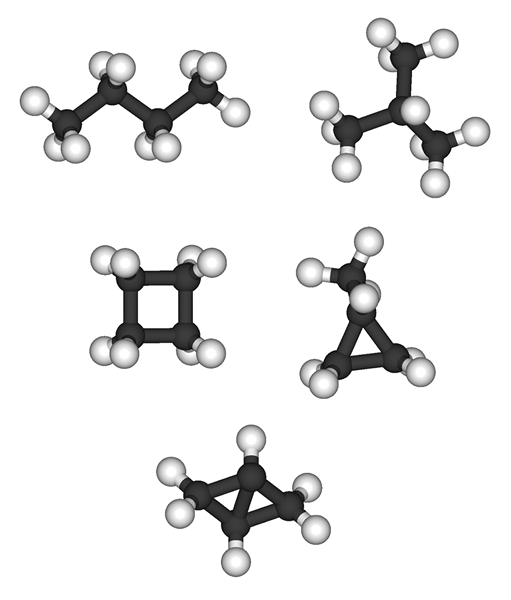
Alkana hanya mengandung ikatan tunggal antara atom karbon dan hidrogen (ikatan C-C dan ikatan C-H). Oleh karena itu, mereka disebut "hidrokarbon jenuh". Menurut model hibridisasi orbital, semua atom karbon dalam alkena memiliki SP3 hibridisasi. Mereka membentuk ikatan sigma dengan atom hidrogen, dan molekul yang dihasilkan memiliki geometri tetrahedron. Alkana dapat dibagi menjadi dua kelompok sesuai dengan pengaturan molekuler mereka; alkana asiklik (cNH2n.+2) dan alkana siklik (cNH2n).
Apa itu alkena?
Alkena adalah hidrokarbon, yang mengandung ikatan rangkap karbon-karbon (C = C). "Olefin" adalah nama lama yang digunakan untuk merujuk pada keluarga alkene. Anggota terkecil dari keluarga ini adalah Ethane (c2H4); dulunya disebut OLEFIANT gas (dalam bahasa Latin: 'oleum ' berarti 'minyak' + 'facere' berarti 'membuat') di masa -masa awal. Ini karena reaksi antara C2H4 dan klorin memberi C2H2Cl2, minyak.
Apa perbedaan antara alkana dan alkena?
Struktur kimia alkana dan alkena
Alkana: Alkana memiliki formula molekul umum CNH2n+2. Metana (ch4) adalah alkana terkecil.
| Nama | Formula Kimia | Struktur asiklik |
| Metana | Ch4 | Ch4 |
| Ethane | C2H6 | Ch3Ch3 |
| Propana | C3H8 | Ch3Ch2Ch3 |
| Butana | C4H10 | Ch3Ch2Ch2Ch3 |
| Pentane | C5H12 | Ch3Ch2Ch2Ch2Ch3 |
| Heksana | C6H14 | Ch3Ch2Ch2 Ch2Ch2Ch3 |
| Heptan | C7H16 | Ch3Ch2Ch2Ch2Ch2Ch2Ch3 |
| Oktan | C8H18 | Ch3 Ch3Ch2Ch2Ch2Ch2Ch3Ch3 |
Alkena: Alkena memiliki formula kimia umum CNH2n. Alkena dianggap sebagai hidrokarbon tak jenuh karena tidak mengandung jumlah maksimum atom hidrogen yang dapat dimiliki oleh molekul hidrokarbon.
| Nama | Formula Kimia | Struktur |
| Ethene | C2H4 | Ch2 = Ch2 |
| Propene | C3H6 | Ch3Ch = ch2 |
| Butene | C4H8 | Ch2 =Chch2Ch3, Ch3Ch = chch3 |
| Pentene | C5H10 | Ch2 =Chch2Ch2Ch3, Ch3Ch = chch2Ch3 |
| Hexene | C6H12 | Ch2 =Chch2 Ch2Ch2Ch3Ch3Ch = chch2Ch2Ch3 Ch3Ch2Ch=Chch2Ch3 |
| Heptene | C7H14 | Ch=Chch2Ch2Ch2Ch2Ch3Ch3Ch = ch2Ch2Ch2Ch2Ch3 |
Sifat kimia alkana dan alkena
Alkana:
Reaktivitas:
Alkana tidak masuk akal untuk banyak reagen kimia. Ini karena ikatan karbon-karbon (C-C) dan karbon-hidrogen (C-H) cukup kuat karena atom karbon dan hidrogen memiliki nilai elektronegativitas yang hampir sama. Oleh karena itu, sangat sulit untuk mematahkan ikatan mereka, kecuali jika mereka dipanaskan hingga suhu yang cukup tinggi.
Pembakaran:
Alkana dapat dengan mudah terbakar di udara. Reaksi antara alkana dengan oksigen berlebih disebut "pembakaran". Dalam reaksi ini, alkana dikonversi menjadi karbon dioksida (CO2) dan air.
CNH2n + (n + n/2) o2 → N co2 + NH2HAI
C4H10 + 13/2 o2 → 4 co2 + 5H2HAI
Air karbon dioksida oksigen butana
Reaksi pembakaran adalah reaksi eksotermik (mereka mengeluarkan panas). Akibatnya, alkana digunakan sebagai sumber energi.
Alkena:
Reaktivitas:
Alkena bereaksi dengan hidrogen dengan adanya katalis logam yang terbagi halus untuk membentuk alkana yang sesuai. Laju reaksi sangat rendah tanpa katalisator.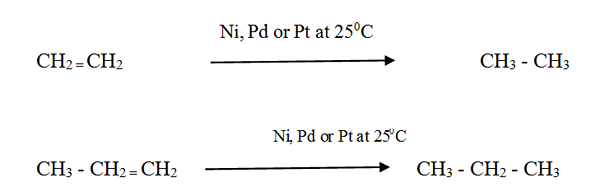
Hidrogenasi katalitik digunakan dalam industri makanan untuk mengubah minyak nabati cair menjadi lemak semi-padat dalam membuat margarin dan lemak masak padat.
Sifat fisik alkana dan alkena
Formulir
Alkana: Alkana ada sebagai gas, cairan dan padatan. Metana, etana, propana dan butana adalah gas pada suhu kamar. Struktur heksana, pentana, dan heptana yang tidak bercabang adalah cairan. Alkana yang memiliki berat molekul yang lebih tinggi adalah padatan.
Ch4 ke c4H10 adalah gas
C5H12 ke c17H36 adalah cairan, dan
Alkana dengan berat molekul yang lebih tinggi adalah padatan lunak
Alkena: Alkena menunjukkan sifat fisik yang sama dari alkana yang sesuai. Alkena yang memiliki berat molekul lebih rendah (c2H4 toc4H8) adalah gas pada suhu kamar dan tekanan atmosfer. Alkena memiliki berat molekul yang lebih tinggi adalah padatan.
Kelarutan:
Alkana: Alkana tidak larut dalam air. Mereka dilarutkan dalam pelarut organik non-polar atau lemah.
Alkena: Alkena adalah molekul polar yang relatif karena ikatan C = C; Oleh karena itu, mereka larut dalam pelarut non-polar atau pelarut polaritas rendah. Air adalah molekul kutub dan alkena sedikit larut dalam air.
Kepadatan:
Alkana: Kepadatan alkana lebih rendah dari kepadatan air. Nilai kepadatan mereka hampir 0.7 g ml-1, Mempertimbangkan kepadatan air sebagai 1.0 G ML-1.
Alkena: Kepadatan alkena lebih rendah dari kepadatan air.
Poin mendidih:
Alkana: Titik didih dari alkana yang tidak bercabang dengan lancar meningkat seiring dengan meningkatnya jumlah atom karbon dan berat molekul. Secara umum, alkana bercabang memiliki titik didih yang lebih rendah dibandingkan dengan alkana yang tidak bercabang, memiliki jumlah atom karbon yang sama.
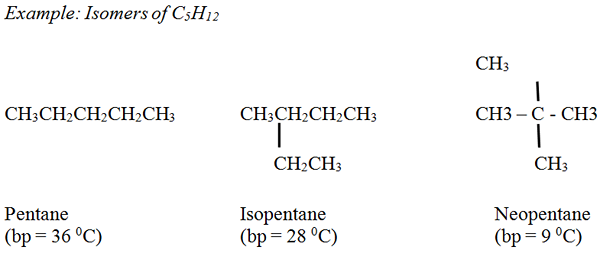
Alkena: Titik mendidih mirip dengan alkana yang sesuai dengan variasi kecil.
Referensi: Cliffsnotes. (N.D.). Diperoleh 06 Juli 2016, dari sini. Zum Directory-Modus. (N.D.). Diperoleh 06 Juli 2016, dari sini Polaritas. (N.D.). Diperoleh 06 Juli 2016, dari sini Momen dipol. (2013). Diperoleh 06 Juli 2016, dari sini Isomer struktural. (N.D.). Diperoleh 06 Juli 2016, dari sini Pengantar alkena. (N.D.). Diperoleh 06 Juli 2016, dari sini Gambar milik: "Nama Alkene" oleh Chris Evans - (CC0) via Commons Wikimedia “Ball-and-stick hidrokarbon C4 jenuh” oleh fvasconcellos-pekerjaan sendiri (domain publik) melalui commons wikimedia