Perbedaan antara Bohr dan model kuantum
Perbedaan utama - model bohr vs kuantum
Model Bohr dan model kuantum adalah model yang menjelaskan struktur atom. Model Bohr juga disebut model Rutherford-Bohr karena merupakan modifikasi dari model Rutherford. Model Bohr diusulkan oleh Niels Bohr pada tahun 1915. Model kuantum adalah model modern dari sebuah atom. Perbedaan utama antara model bohr dan kuantum adalah itu Model Bohr menyatakan bahwa elektron berperilaku sebagai partikel sedangkan Model kuantum menjelaskan bahwa elektron memiliki perilaku partikel dan gelombang.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu model bohr
3. Apa itu model kuantum
4. Perbandingan berdampingan - model bohr vs kuantum dalam bentuk tabel
5. Ringkasan
Apa itu model bohr?
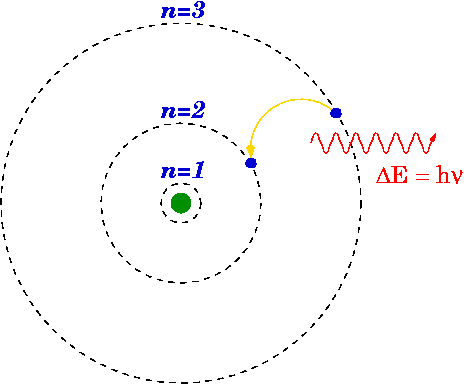
Seperti disebutkan di atas, model Bohr adalah modifikasi dari model Rutherford karena model Bohr menjelaskan struktur atom yang terdiri dari nukleus yang dikelilingi oleh elektron. Tetapi model Bohr lebih maju daripada model Rutherford karena dikatakan bahwa, elektron selalu bepergian dengan cangkang atau orbit tertentu di sekitar nukleus. Ini juga menyatakan bahwa cangkang ini memiliki energi yang berbeda dan berbentuk bulat. Yang disarankan dengan pengamatan spektrum garis untuk atom hidrogen.
Karena adanya garis diskrit dalam spektrum garis, Bohr menyatakan bahwa orbital atom memiliki energi dan elektron yang tetap dapat melompat dari satu tingkat energi ke energi yang memancarkan atau menyerap lainnya, menghasilkan garis dalam spektrum garis pada garis garis garis garis.
Deposulat utama model Bohr
-
Elektron bergerak di sekitar nukleus dalam orbital bola yang memiliki ukuran dan energi tetap.
- Setiap orbit memiliki jari -jari yang berbeda dan dinamai dari nukleus ke luar sebagai n = 1, 2, 3, dll. atau n = k, l, m, dll. dimana n adalah nomor tingkat energi tetap.
- Energi orbital terkait dengan ukurannya.
- Orbit terkecil memiliki energi terendah. Atom benar -benar stabil saat elektron berada di tingkat energi terendah.
- Saat elektron bergerak dalam orbital tertentu, energi elektron itu konstan.
- Elektron dapat berpindah dari satu tingkat energi ke tingkat energi lainnya dengan menyerap atau melepaskan energi.
-
Gerakan ini menyebabkan radiasi.
Model Bohr sangat cocok dengan atom hidrogen yang memiliki elektron tunggal dan nukleus bermuatan positif kecil. Selain itu, Bohr menggunakan konstanta papan untuk menghitung energi tingkat energi atom.

Gambar 01: Model Bohr untuk Hidrogen
Tetapi ada beberapa kelemahan model Bohr ketika menjelaskan struktur atom atom selain hidrogen.
Keterbatasan Model Bohr
- Model Bohr tidak dapat menjelaskan efek Zeeman (efek medan magnet pada spektrum atom).
- Itu tidak dapat menjelaskan efek mencolok (efek medan listrik pada spektrum atom).
- Model Bohr gagal menjelaskan spektrum atom atom yang lebih besar.
Apa itu model kuantum?
Meskipun model kuantum jauh lebih sulit untuk dipahami daripada model Bohr, itu secara akurat menjelaskan pengamatan tentang atom besar atau kompleks. Model kuantum ini didasarkan pada teori kuantum. Menurut teori kuantum, elektron memiliki dualitas gelombang partikel dan tidak mungkin untuk menemukan posisi yang tepat dari elektron (prinsip ketidakpastian). Dengan demikian, model ini terutama didasarkan pada probabilitas elektron untuk berada di mana saja di orbital. Itu juga menyatakan bahwa orbital tidak selalu bulat. Orbital memiliki bentuk khusus untuk tingkat energi yang berbeda dan struktur 3D.
Menurut model kuantum, elektron dapat diberi nama dengan menggunakan angka kuantum. Empat jenis angka kuantum digunakan dalam hal ini;
- Nomor kuantum prinsip, n
- Nomor kuantum momentum sudut, i
- Angka kuantum magnetik, ml
- Putar nomor kuantum, mS
Itu Nomor kuantum prinsip menjelaskan jarak rata -rata orbital dari nukleus dan tingkat energi. Itu Nomor kuantum momentum sudut menjelaskan bentuk orbital. Itu Nomor kuantum magnetik menggambarkan orientasi orbital di ruang angkasa. Itu putar nomor kuantum memberikan pemintalan elektron dalam medan magnet dan karakteristik gelombang elektron.
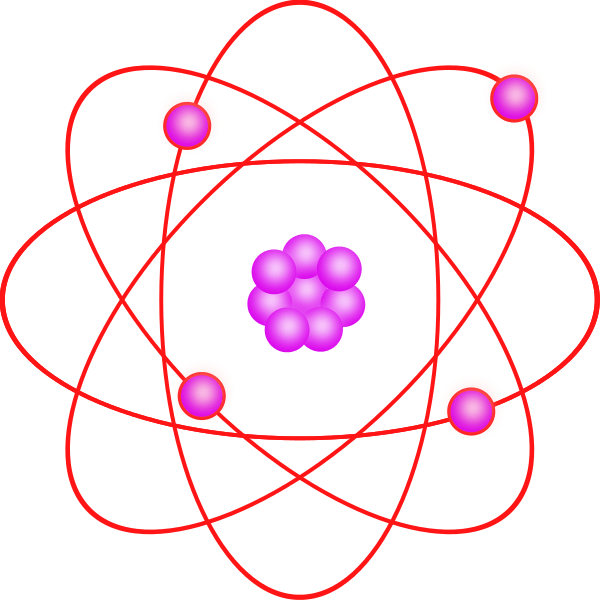
Gambar 2: Struktur spasial orbital atom.
Apa perbedaan antara model bohr dan kuantum?
Model bohr vs kuantum | |
| Model Bohr adalah model atom yang diusulkan oleh Niels Bohr (pada tahun 1915) untuk menjelaskan struktur atom. | Model kuantum adalah model atom yang dianggap sebagai model atom modern untuk menjelaskan struktur atom secara akurat. |
| Perilaku elektron | |
| Model Bohr menjelaskan perilaku partikel elektron. | Model kuantum menjelaskan dualitas gelombang-partikel elektron. |
| Aplikasi | |
| Model Bohr dapat diterapkan untuk atom hidrogen tetapi tidak untuk atom besar. | Model kuantum dapat digunakan untuk atom apa saja, termasuk yang lebih kecil dan atom besar dan kompleks. |
| Bentuk orbital | |
| Model Bohr tidak menggambarkan bentuk yang tepat dari setiap orbital. | Model kuantum menggambarkan semua bentuk yang mungkin dapat dimiliki orbital. |
| Efek elektro-magnetik | |
| Model Bohr tidak menjelaskan efek Zeeman (efek medan magnet) atau efek mencolok (efek medan listrik). | Model Quantum menjelaskan efek Zeeman dan Stark secara tepat. |
| Angka kuantum | |
| Model Bohr tidak menggambarkan angka kuantum selain dari angka kuantum prinsip. | Model kuantum menggambarkan keempat angka kuantum dan karakteristik elektron. |
Ringkasan - Model Bohr vs Quantum
Meskipun beberapa model atom yang berbeda diusulkan oleh para ilmuwan, model yang paling menonjol adalah model Bohr dan model kuantum. Kedua model ini terkait erat tetapi model kuantum jauh lebih rinci daripada model bohr. Menurut model Bohr, elektron berperilaku sebagai partikel sedangkan model kuantum menjelaskan bahwa elektron memiliki perilaku partikel dan gelombang. Ini adalah perbedaan utama antara Bohr dan model kuantum.
Unduh Versi PDF dari Model Bohr vs Quantum
Anda dapat mengunduh versi PDF artikel ini dan menggunakannya untuk tujuan offline sesuai catatan kutipan. Silakan unduh Versi PDF di sini Perbedaan antara Bohr dan Model Quantum.
Referensi:
1. “Model Bohr dari Atom | Teori atom Schrodinger." Kimia. Kelas Byjus, 08 Nov. 2016. Web. Tersedia disini. 05 Juni 2017.
2. “Struktur Atom: Model Mekanik Kuantum.”Dummies. N.P., N.D. Web. Tersedia disini. 05 Juni 2017.
Gambar milik:
1. “Model Bohr Balmer 32” (CC BY-SA 3.0) Via Commons Wikimedia
2. "Atom Clipart Violet" (domain publik) melalui Commons Wikimedia


