Perbedaan antara sel konsentrasi dan sel kimia
Itu perbedaan utama antara sel konsentrasi dan sel kimia adalah itu, Dalam sel konsentrasi, komposisi dua sel setengah sama sedangkan, dalam sel kimia, komposisi mungkin atau mungkin tidak serupa.
Sel konsentrasi adalah jenis sel elektrokimia. Ada dua jenis sel elektrokimia atau sel kimia sebagai sel galvanik dan sel elektrolitik. Sel konsentrasi adalah jenis sel galvanik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu sel konsentrasi
3. Apa itu sel kimia
4. Perbandingan berdampingan - sel konsentrasi vs sel kimia dalam bentuk tabel
5. Ringkasan
Apa itu sel konsentrasi?
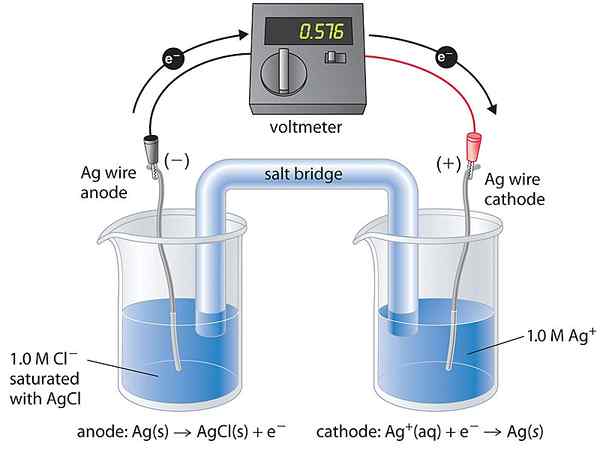
Sel konsentrasi adalah jenis sel galvanik di mana dua sel setengah sel serupa dalam komposisi. Oleh karena itu, kami mengatakan kedua sel setengah itu setara. Mereka hanya berbeda dalam konsentrasi. Tegangan yang dihasilkan oleh sel ini sangat kecil karena sel ini cenderung mendapatkan keadaan kesetimbangan. Keseimbangan datang ketika konsentrasi dua sel setengah menjadi sama.

Sel konsentrasi menghasilkan listrik melalui pengurangan energi bebas termodinamika dari sistem. Karena komposisi setengah sel adalah serupa, reaksi yang sama terjadi, tetapi di arah yang berlawanan. Jadi, proses ini meningkatkan konsentrasi sel konsentrasi yang lebih rendah dan mengurangi konsentrasi sel konsentrasi yang lebih tinggi. Saat listrik mengalir, energi termal dihasilkan. Sel menyerap energi ini sebagai panas. Ada dua jenis sel konsentrasi sebagai berikut:
- Sel konsentrasi elektrolit - Elektroda terdiri dari zat yang sama, dan setengah sel mengandung elektrolit yang sama dengan konsentrasi yang berbeda
- Sel konsentrasi elektroda - Dua elektroda (zat yang sama) dari konsentrasi yang berbeda dicelupkan ke dalam elektrolit yang sama
Apa itu sel kimia
Sel kimia, lebih tepatnya sel elektrokimia, adalah sistem (perangkat) yang dapat menghasilkan energi listrik melalui reaksi kimia spontan. Reaksi kimia yang terlibat dalam proses ini disebut reaksi redoks. Reaksi ini terjadi melalui transfer elektron antara spesies kimia. Selain itu, reaksi redoks memiliki dua reaksi setengah yang dikenal sebagai reaksi oksidasi dan reaksi reduksi. Sementara reaksi oksidasi selalu melepaskan elektron ke sistem, reaksi reduksi mengambil elektron dari sistem. Dengan demikian, kita dapat mengatakan bahwa dua reaksi setengah terjadi secara bersamaan.
Ada dua jenis sel elektrokimia sebagai sel volta (galvanik) dan sel elektrolitik. Sel elektrokimia terdiri dari dua setengah sel. Setengah reaksi terjadi pada dua sel setengah ini. Selain itu, reaksi kimia yang terjadi dalam sel menyebabkan penumpukan perbedaan potensial antara dua sel setengah.
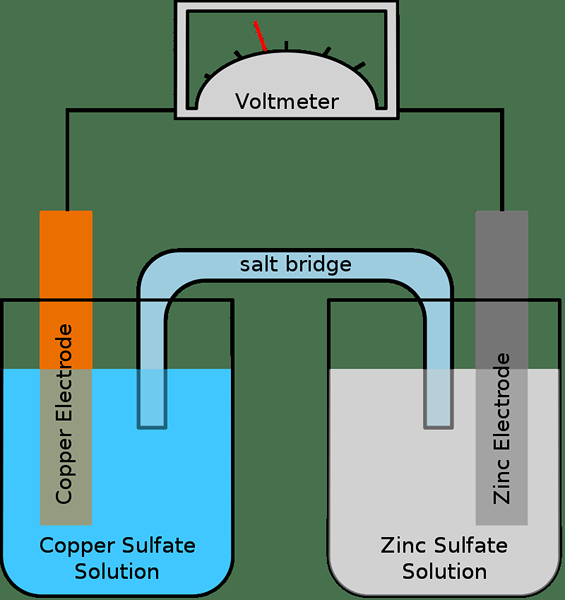
Gambar 01: Sel galvanik sederhana
Setengah sel umumnya terdiri dari elektroda dan elektrolit. Oleh karena itu, sel elektrokimia lengkap memiliki dua elektroda dan dua elektrolit; Dua sel setengah terkadang dapat menggunakan elektrolit yang sama. Jika ada dua elektrolit yang berbeda, maka jembatan garam digunakan untuk mempertahankan kontak antara elektrolit. Dan, ini dilakukan dengan membuat bagian untuk mentransfer ion melalui jembatan garam. Elektron mengalir dari satu setengah sel ke yang lain melalui sirkuit eksternal. Kami menyebut dua anoda elektroda dan katoda ini.
Selain itu, reaksi oksidasi dan reduksi terjadi pada dua elektroda secara terpisah. Sementara reaksi oksidasi terjadi pada anoda, reaksi reduksi terjadi pada katoda. Oleh karena itu, elektron diproduksi di anoda dan mereka bergerak dari anoda ke katoda melalui sirkuit eksternal. Jembatan garam membantu mempertahankan sistem netral (secara elektrik) dengan mentransfer ion melalui itu untuk menyeimbangkan muatan listrik.
Apa perbedaan antara sel konsentrasi dan sel kimia?
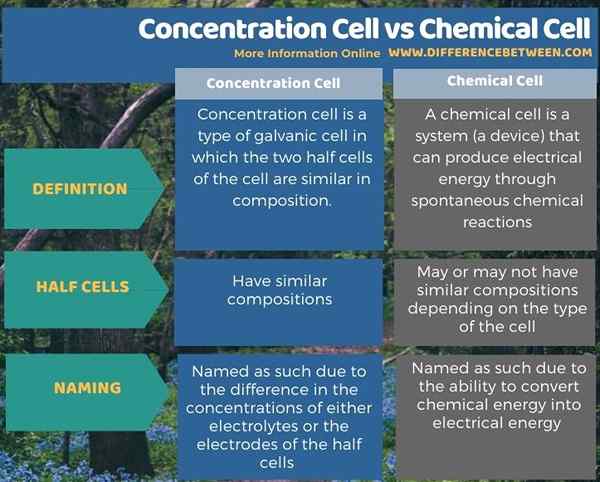
Sel konsentrasi adalah jenis sel elektrokimia. Ada dua jenis sel kimia; Mereka adalah sel galvanik dan sel elektrolitik. Sel konsentrasi adalah jenis sel galvanik. Perbedaan utama antara sel konsentrasi dan sel kimia adalah bahwa dalam sel konsentrasi, komposisi dua sel setengah sama sedangkan, dalam sel kimia, komposisi mungkin atau mungkin tidak serupa.
Di bawah ini adalah ringkasan perbedaan antara sel konsentrasi dan sel kimia.
Ringkasan -Sel Konsentrasi Vs Sel Kimia
Sel konsentrasi adalah jenis sel elektrokimia. Ada dua jenis sel kimia (elektrokimia) dapat sebagai sel galvanik dan sel elektrolitik. Tepatnya, sel konsentrasi adalah jenis sel galvanik. Perbedaan utama antara sel konsentrasi dan sel kimia adalah bahwa dalam sel konsentrasi komposisi dua sel setengah sama sedangkan dalam sel kimia komposisi mungkin atau mungkin tidak serupa.
Referensi:
1. Narendra Sriramula. “Sel Kimia.”Slideshare.bersih. Tersedia disini.
Gambar milik:
1. "Sel 3" oleh 473Shruthi V - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. "Galvanic Cell" oleh Gringer - File: Galvanische Zelle.PNG, oleh Tinux (CC BY-SA 3.0) Via Commons Wikimedia


