Perbedaan antara pasukan dispersi dipol-dipol dan London
Perbedaan utama - Pasukan Dispersi Dipole-Dipole vs London
Pasukan dispersi dipol-dipol dan London adalah dua kekuatan daya tarik yang ditemukan antara molekul atau atom; Mereka secara langsung mempengaruhi titik didih atom /molekul. Itu perbedaan utama Antara Dipole-Dipole dan Pasukan Dispersi London adalah kekuatan mereka dan di mana mereka dapat ditemukan. Itu Kekuatan kekuatan dispersi London relatif lebih lemah dari interaksi dipol-dipol; Namun kedua atraksi ini lebih lemah dari ikatan ionik atau kovalen. Kekuatan dispersi London dapat ditemukan dalam molekul apa pun atau kadang-kadang dalam atom, tetapi interaksi dipol-dipol hanya ditemukan dalam molekul kutub.
Apa itu Dipole-Dipole Force?
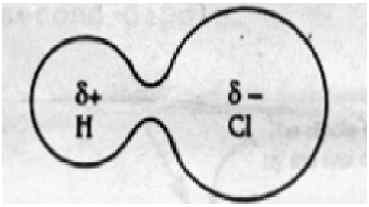
Interaksi dipol-dipol terjadi ketika dua molekul terpolarisasi yang berlawanan berinteraksi melalui ruang angkasa. Kekuatan -kekuatan ini ada di semua molekul yang kutub. Molekul polar terbentuk ketika dua atom memiliki perbedaan elektronegativitas ketika mereka membentuk ikatan kovalen. Dalam hal ini, atom tidak dapat berbagi elektron secara merata antara dua atom karena perbedaan elektronegativitas. Atom yang lebih elektronegatif menarik awan elektron lebih dari atom elektronegatif yang kurang; sehingga molekul yang dihasilkan memiliki ujung yang sedikit positif dan ujung yang sedikit negatif. Dipol positif dan negatif dalam molekul lain dapat saling menarik, dan daya tarik ini disebut gaya dipol-dipol.

Apa itu London Kekuatan dispersi?
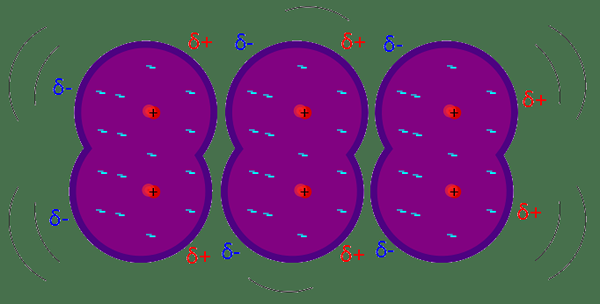
Kekuatan dispersi London dianggap sebagai gaya antarmolekul terlemah antara molekul atau atom yang berdekatan. Kekuatan dispersi London mengakibatkan ketika ada fluktuasi distribusi elektron dalam molekul atau atom. Misalnya; Jenis gaya tarik ini muncul pada atom tetangga karena dipol instan pada atom apa pun. Ini menginduksi dipol pada atom tetangga dan kemudian menarik satu sama lain melalui gaya tarik yang lemah. Besarnya gaya dispersi London tergantung pada seberapa mudah elektron pada atom atau dalam molekul dapat terpolarisasi sebagai respons terhadap gaya sesaat. Mereka adalah kekuatan sementara yang mungkin tersedia dalam molekul apa pun karena mereka memiliki elektron.

Apa perbedaan antara pasukan dispersi dipol-dipol dan London?
Definisi:
Pasukan dipol-dipol: Gaya dipol-dipol adalah gaya tarik antara dipol positif molekul polar dan dipol negatif dari molekul terpolarisasi yang berlawanan lainnya.
London Dispersion Force: London Dispersion Force adalah gaya menarik sementara antara molekul atau atom yang berdekatan ketika ada fluktuasi dalam distribusi elektron.
Alam:
Pasukan dipol-dipol: Interaksi dipol-dipol ditemukan dalam molekul kutub seperti HCl, BRCL, dan HBR. Ini muncul ketika dua molekul berbagi elektron secara tidak merata untuk membentuk ikatan kovalen. Kepadatan elektron bergeser ke arah atom yang lebih elektronegatif, menghasilkan dipol yang sedikit negatif di satu ujung dan dipol sedikit positif di ujung lainnya.
London Dispersion Force: Pasukan dispersi London dapat ditemukan dalam atom atau molekul apa pun; Persyaratannya adalah awan elektron. Kekuatan dispersi London juga ditemukan dalam molekul dan atom non-polar.
Kekuatan:
Pasukan dipol-dipol: Kekuatan dipol dipol lebih kuat dari kekuatan dispersi tetapi lebih lemah dari ikatan ionik dan kovalen. Kekuatan rata-rata gaya dispersi bervariasi antara1-10 kkal/mol.
London Dispersion Force: Mereka lemah karena kekuatan dispersi London adalah kekuatan sementara (0-1 kkal/mol).
Faktor yang mempengaruhi:
Pasukan dipol-dipol: Faktor yang mempengaruhi kekuatan gaya dipol-dipol adalah perbedaan elektronegativitas antara atom dalam molekul, ukuran molekul dan bentuk molekul. Dengan kata lain, ketika panjang ikatan meningkatkan interaksi dipol berkurang.
London Dispersion Force: Besarnya kekuatan dispersi London tergantung pada beberapa faktor. Itu meningkat dengan jumlah elektron dalam atom. Polarizability adalah salah satu faktor penting yang mempengaruhi kekuatan dalam kekuatan dispersi London; Ini adalah kemampuan untuk mendistorsi awan elektron dengan atom/molekul lain. Molekul yang memiliki elektronegativitas yang lebih rendah dan jari -jari yang lebih besar memiliki polarisasi yang lebih tinggi. Sebaliknya; Sulit untuk mendistorsi awan elektron dalam atom yang lebih kecil karena elektron sangat dekat dengan nukleus.
Contoh:
| Atom | Titik didih / HaiC | |
| Helium | (Dia) | -269 |
| Neon | (NE) | -246 |
| Argon | (AR) | -186 |
| Krypton | (KR) | -152 |
| Xenon | (Xe) | -107 |
| Redon | (RN) | -62 |
RN- Semakin besar atom, mudah dipolarisasi (polarizabilitas yang lebih tinggi) dan memiliki kekuatan menarik terkuat. Helium sangat kecil dan sulit untuk didistorsi dan menghasilkan kekuatan dispersi London yang lebih lemah.
Gambar milik:
1. Dipole-Dipole-Interaction-in-HCl-2D oleh Benjah-BMM27 (pekerjaan sendiri) [domain publik], melalui Wikimedia Commons
2. Forze di London oleh Riccardo Rovinetti (Pekerjaan sendiri) [CC BY-SA 3.0], via Wikimedia Commons


