Perbedaan antara entalpi atomisasi dan disosiasi ikatan
Itu perbedaan utama Antara entalpi atomisasi dan disosiasi ikatan adalah itu Entalpi atomisasi menggambarkan energi yang diperlukan untuk memisahkan molekul ke dalam atom -atomnya sedangkan entalpi disosiasi ikatan menggambarkan disosiasi ikatan kimia dalam molekul.
Terkadang, entalpi atomisasi dan entalpi disosiasi ikatan adalah sama untuk beberapa senyawa sederhana jika ada ikatan sederhana. Ini karena, dalam senyawa sederhana, disosiasi ikatan membentuk atom dari mana molekulnya terbuat dari.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa entalpi atomisasi
3. Apa entalpi disosiasi ikatan
4. Perbandingan berdampingan -Entalpi atomisasi vs disosiasi ikatan dalam bentuk tabel
5. Ringkasan
Apa entalpi atomisasi?
Enthalpy atomisasi adalah perubahan entalpi yang terjadi saat memisahkan zat kimia sepenuhnya menjadi atomnya. Zat kimia ini dapat berupa elemen kimia atau senyawa kimia. Kita dapat menunjukkan perubahan entalpi ini sebagai ΔHpada. Selama proses atomisasi, semua jenis ikatan kimia dipecah, dan tidak ada yang terbentuk. Oleh karena itu, entalpi atomisasi selalu merupakan nilai positif. Nilai entalpi standar untuk perubahan entalpi ini adalah "entalpi standar atomisasi". Kondisi standar yang dipertimbangkan dalam konteks ini adalah 268.Suhu 15 K dan 1 tekanan bar.
Misalnya, entalpi atomisasi untuk molekul air mengacu pada energi yang diperlukan untuk memisahkan dua atom hidrogen dan atom oksigen dalam molekul air. Dengan kata lain, entalpi atomisasi air adalah jumlah dari energi disosiasi ikatan dari dua ikatan O-H. Demikian pula, entalpi atomisasi untuk padatan unsur adalah entalpi sublimasi untuk zat itu karena sublimasi melibatkan konversi padatan menjadi gas monoatomik setelah penguapan.
Apa entalpi disosiasi ikatan?
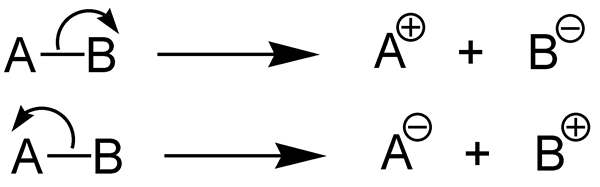
Entralpi disosiasi ikatan menggambarkan perubahan entalpi yang terjadi selama disosiasi ikatan kimia. Dengan kata lain, itu adalah ukuran kekuatan ikatan kimia. Oleh karena itu, kita dapat mengatakan bahwa perubahan entalpi standar yang terjadi ketika ikatan kimia A-B rusak oleh hemolisis dan fragmen A dan B adalah entalpi dari disosiasi ikatan. Jika molekul yang kita pertimbangkan adalah molekul diatomik, maka entalpi disosiasi ikatan sama dengan entalpi atomisasi. Biasanya, fragmen A dan B yang diberikan oleh disosiasi ikatan ini adalah spesies radikal. Kita dapat menunjukkan entalpi disosiasi ikatan sebagai DH0.

Ada berbagai metode yang dapat kita gunakan untuk mengukur disosiasi ikatan seperti penentuan spektrometri tingkat energi, pembentukan radikal dengan pirolisis atau fotolisis, pengukuran kinetika kimia dan keseimbangan, berbagai metode kalorimetri dan elektrokimia, dll.
Apa perbedaan antara entalpi atomisasi dan disosiasi ikatan?
Perbedaan utama antara entalpi atomisasi dan disosiasi ikatan adalah bahwa entalpi atomisasi menggambarkan energi yang diperlukan untuk memisahkan molekul ke dalam atom -atomnya sedangkan entalpi disosiasi ikatan menggambarkan disosiasi ikatan kimia dalam molekul. Disosiasi ikatan entalpi dan entalpi atomisasi selalu merupakan nilai positif. Terkadang, entalpi atomisasi dan entalpi disosiasi ikatan adalah sama untuk beberapa senyawa sederhana jika ada ikatan sederhana. Namun, istilah -istilah ini berbeda satu sama lain sebagian besar waktu.
Di bawah tabel infografis lebih banyak perbedaan antara entalpi atomisasi dan disosiasi ikatan.
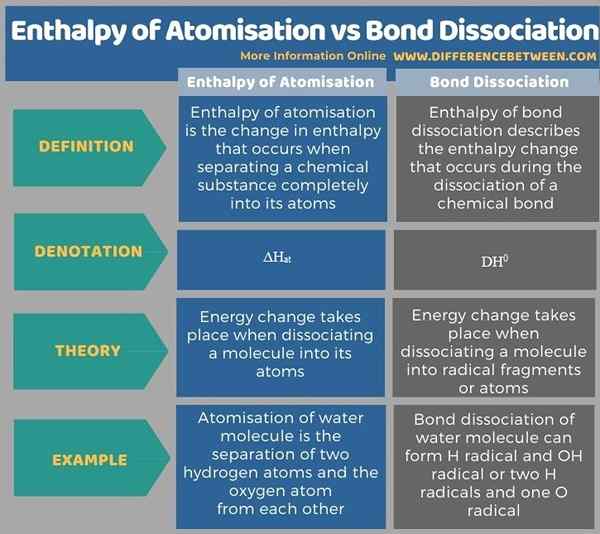
Ringkasan -Entalpi atomisasi vs disosiasi ikatan
Entalpi atomisasi dan disosiasi ikatan dapat digunakan secara bergantian untuk beberapa senyawa sederhana, tetapi tidak selalu mereka setara. Perbedaan utama antara entalpi atomisasi dan disosiasi ikatan adalah bahwa entalpi atomisasi menggambarkan energi yang diperlukan untuk memisahkan molekul ke dalam atom -atomnya sedangkan entalpi disosiasi ikatan menggambarkan disosiasi ikatan kimia dalam molekul.
Referensi:
1. “Entralpi atomisasi.”Wikipedia, tersedia di sini.
Gambar milik:
1. "Heterolisis (Kimia)" oleh Jürgen Martens - Jürgen Martens (CC BY -SA 3.0) Via Commons Wikimedia


