Perbedaan antara energi bebas dan energi aktivasi
Itu perbedaan utama antara energi bebas dan energi aktivasi adalah itu Energi bebas adalah jumlah Energi tersedia untuk sistem termodinamika untuk melakukan pekerjaan termodinamika, sedangkan energi aktivasi reaksi kimia adalah penghalang energi yang harus diatasi untuk mendapatkan produk dari reaksi.
Energi bebas dan energi aktivasi adalah dua istilah berbeda yang memiliki aplikasi berbeda juga. Istilah energi bebas digunakan mengenai sistem termodinamika dalam kimia fisik, sedangkan istilah energi aktivasi terutama digunakan mengenai reaksi kimia dalam biokimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu energi bebas
3. Apa itu energi aktivasi
4. Perbandingan berdampingan - energi bebas vs energi aktivasi dalam bentuk tabel
5. Ringkasan
Apa itu energi bebas?
Energi bebas adalah jumlah energi yang tersedia untuk sistem termodinamika untuk melakukan pekerjaan termodinamika. Energi bebas memiliki dimensi energi. Nilai energi bebas dari sistem termodinamika ditentukan oleh keadaan sistem saat ini, bukan oleh sejarahnya. Ada dua jenis utama energi bebas yang sering dibahas dalam termodinamika: energi bebas helmholtz dan energi bebas gibbs.
Energi bebas helmholtz adalah energi yang tersedia dalam sistem termodinamika tertutup untuk melakukan pekerjaan termodinamika pada suhu dan volume konstan. Oleh karena itu, nilai negatif energi helmholtz menunjukkan pekerjaan maksimum yang dapat dilakukan oleh sistem termodinamika dengan menahan konstanta volumenya. Untuk menjaga volume konstan, beberapa pekerjaan termodinamika total dilakukan sebagai pekerjaan batas (untuk menjaga batas sistem sebagaimana adanya).
Gibbs Free Energy adalah energi yang tersedia dalam sistem termodinamika tertutup untuk melakukan pekerjaan termodinamika pada suhu dan tekanan konstan. Volume sistem dapat bervariasi. Energi bebas dilambangkan dengan g.
Apa itu energi aktivasi?
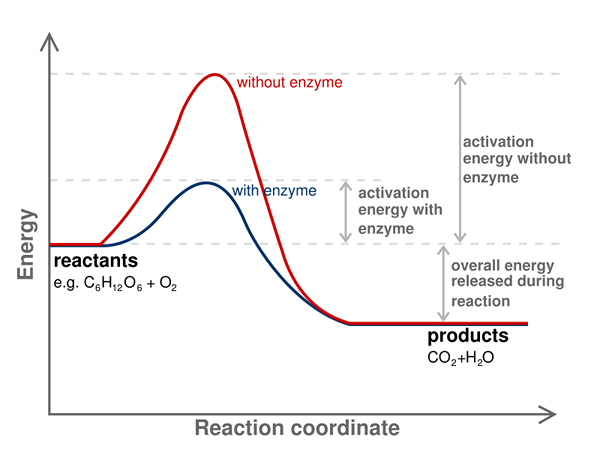
Energi aktivasi reaksi kimia adalah penghalang energi yang harus diatasi untuk mendapatkan produk dari reaksi. Dengan kata lain, itu adalah energi minimum yang diperlukan untuk reaktan untuk dikonversi menjadi suatu produk. Selalu perlu untuk menyediakan energi aktivasi untuk memulai reaksi kimia.
Kami menunjukkan energi aktivasi sebagai eA atau AE; Kami mengukurnya dengan unit kJ/mol. Selain itu, energi aktivasi dianggap sebagai energi minimum yang diperlukan untuk membentuk perantara dengan energi potensial tertinggi dalam reaksi kimia. Beberapa reaksi kimia memiliki perkembangan yang lambat dan terjadi melalui dua langkah atau lebih. Di sini, perantara dibentuk dan kemudian disusun kembali untuk membentuk produk akhir. Dengan demikian, energi yang diperlukan untuk memulai reaksi itu adalah energi yang diperlukan untuk membentuk perantara dengan energi potensial tertinggi.

Selain itu, katalis dapat mengurangi energi aktivasi. Oleh karena itu, katalis sering digunakan untuk mengatasi penghalang energi dan membiarkan reaksi kimia berkembang. Enzim adalah katalis biologis yang dapat mengurangi energi aktivasi reaksi yang terjadi di jaringan.
Apa perbedaan antara energi bebas dan energi aktivasi?
Energi bebas dan energi aktivasi adalah dua istilah berbeda yang memiliki aplikasi berbeda juga. Perbedaan utama antara energi bebas dan energi aktivasi adalah bahwa energi bebas adalah jumlah energi yang tersedia untuk sistem termodinamika untuk melakukan pekerjaan termodinamika, sedangkan energi aktivasi reaksi kimia adalah penghalang energi yang harus diatasi untuk mendapatkan produk dari reaksinya.
Di bawah ini adalah ringkasan perbedaan antara energi bebas dan energi aktivasi dalam bentuk tabel.
Ringkasan -Energi Energi Gratis vs Aktivasi
Energi bebas dan energi aktivasi adalah dua istilah berbeda yang memiliki aplikasi yang berbeda. Perbedaan utama antara energi bebas dan energi aktivasi adalah bahwa energi bebas adalah jumlah energi yang tersedia untuk sistem termodinamika untuk melakukan pekerjaan termodinamika, sedangkan energi aktivasi reaksi kimia adalah penghalang energi yang harus diatasi untuk mendapatkan produk dari reaksinya.
Referensi:
1. Helmenstine, Anne Marie. “Definisi energi aktivasi dalam kimia."Thoughtco, Aug. 27, 2020, tersedia di sini.
Gambar milik:
1. "Activation2 Diperbarui" yang awalnya diunggah oleh Jerry Crimson Mann, diveksia oleh Tutmosis, dikoreksi oleh fvasconcellos - en: Image: Activation2.PNG (CC BY-SA 3.0) Via Commons Wikimedia


