Perbedaan antara H2S dan SO2
Itu perbedaan utama Antara H2S dan SO2 adalah itu H2S memiliki bau telur busuk, sedangkan SO2 memiliki bau korek api yang terbakar.
H2S dan SO2 adalah senyawa gas pada suhu kamar. Senyawa ini mengandung atom belerang. H2S adalah hidrida sulfur sedangkan SO2 adalah oksida belerang. Selain itu, kedua gas ini memiliki bau yang pedas.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu H2S
3. Apa itu SO2
4. Perbandingan berdampingan -H2S vs SO2 dalam bentuk tabel
5. Ringkasan
Apa itu H2S?
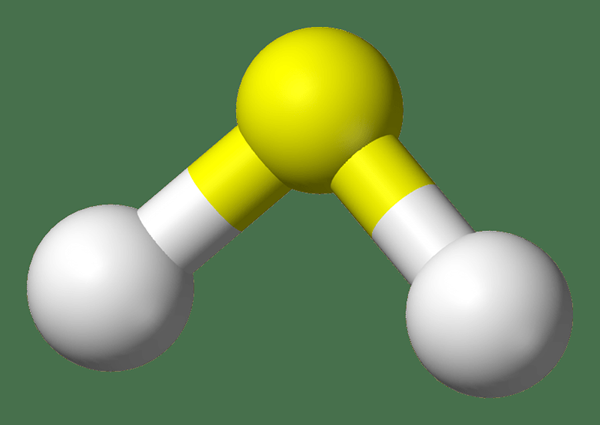
H2S adalah hidrogen sulfida. Itu adalah gas pada suhu kamar, memiliki bau telur busuk. Oleh karena itu, ia memiliki bau yang pedas dan menjengkelkan. Gas ini sangat beracun. Apalagi korosif dan mudah terbakar juga. Karena itu, kita perlu menanganinya dengan cermat. Massa molar H2S adalah 38.09 g/mol. Itu muncul sebagai gas tidak berwarna.
Gas H2S sedikit lebih padat dari udara atmosfer normal. Namun, campuran udara dan H2 dapat menyebabkan reaksi ledakan. Selain itu, gas ini terbakar di udara dengan api biru di atas keberadaan gas oksigen. Reaksi ini memberi SO2 dan air. Secara umum, gas H2S bertindak sebagai zat pereduksi karena hanya dapat mengalami oksidasi karena atom sulfur dalam senyawa ini dalam keadaan oksidasi paling sedikit (tidak dapat dikurangi lebih lanjut).

Gambar 01: Struktur gas H2S
Kita bisa menggunakan h2s untuk mendapatkan belerang unsur. Reaksi antara H2S dan SO2 di hadapan katalis dan suhu tinggi memberikan sulfur dan air unsur. Ini adalah metode penting untuk membuang H2S. Selain itu, H2S sedikit larut dalam air dan pada saat pembubaran, ia dapat membentuk asam lemah.
H2 dapat bereaksi dengan logam dan membentuk logam sulfida. Sulfida logam ini adalah senyawa yang tidak larut dalam air yang memiliki warna gelap. Misalnya, kita dapat menggunakan kertas terapan timbal (ii) asetat untuk mendeteksi H2S yang berevolusi dari sampel karena timbal dalam kertas dapat bereaksi dengan H2S yang membentuk lead warna hitam sulfida.
Apa itu SO2?
SO2 adalah belerang dioksida. Ini adalah gas beracun yang tidak berwarna dan memiliki bau korek api yang terbakar. Di alam, gas ini berevolusi dari letusan gunung berapi. Massa molar gas ini adalah 64.8 g/mol. Itu sedikit larut dalam air dan pada saat pembubaran, itu membentuk asam belerang. Selain itu, gas ini dapat mengalami reaksi oksidasi dan reduksi karena atom belerang dalam molekul ini berada di antara paling sedikit dan keadaan oksidasi tertinggi yang dapat ditunjukkan oleh atom belerang. Oleh karena itu, SO2 dapat bertindak sebagai agen pereduksi dan sebagai agen pengoksidasi.
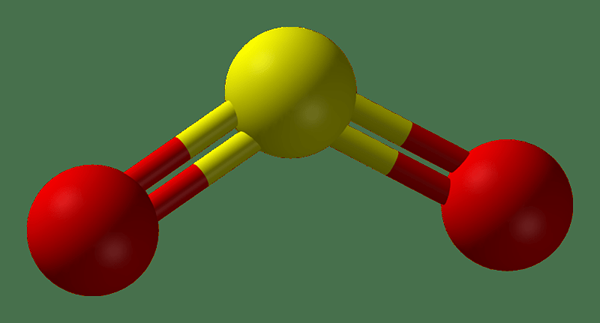
Gambar 02: Struktur Gas SO2
Saat mempertimbangkan produksi SO2, itu terutama diproduksi dari pembuatan asam sulfat. Selain itu, gas SO2 adalah produk dari belerang yang terbakar (atau bahan pembakaran yang mengandung belerang). Selain itu, gas ini adalah produk sampingan dari pembuatan semen kalsium silikat. Kita dapat menghasilkan SO2 dari reaksi dasar berair dengan SO2.
Apa perbedaan antara H2S dan SO2?
H2S dan SO2 adalah senyawa gas pada suhu kamar. Perbedaan utama antara H2S dan SO2 adalah bahwa H2S memiliki bau telur busuk, sedangkan SO2 memiliki bau korek api yang terbakar. Oleh karena itu, kedua gas ini memiliki bau yang pedas. Selain itu, kami dapat menghasilkan H2S melalui pemisahan gas asam sementara kami dapat menghasilkan SO2 sebagai produk sampingan dari pembuatan asam sulfat.
Saat mempertimbangkan penggunaan gas -gas ini, kita dapat menggunakan H2S untuk produksi sulfur unsur, dalam analisis kualitatif logam, sebagai prekursor logam sulfida, dll., Sedangkan SO2 berguna sebagai prekursor untuk asam sulfat, sebagai aditif makanan, sebagai zat pereduksi, dalam pembuatan anggur, dll.
Di bawah infografis merangkum perbedaan antara H2S dan SO2.
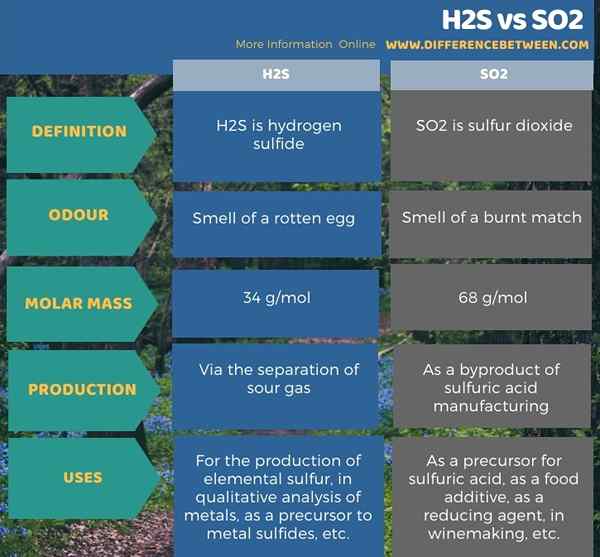
Ringkasan -H2S vs SO2
H2S dan SO2 adalah senyawa gas pada suhu kamar. Perbedaan utama antara H2S dan SO2 adalah bahwa H2S memiliki bau telur busuk, sedangkan SO2 memiliki bau korek api yang terbakar.
Referensi:
1. Helmenstine, Anne Marie, “10 Fakta Sulfur Menarik."Thoughtco, OCT. 8, 2019, tersedia di sini.
Gambar milik:
1. “Hydrogen-Sulfide-3D-Balls” oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia
2. “Sulphur-Dioxide-3D-Balls” oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia


