Perbedaan antara KSP dan Keq

Itu perbedaan utama Antara KSP dan Keq adalah itu Istilah KSP menggambarkan kelarutan suatu zat, sedangkan istilah keq menggambarkan keadaan keseimbangan dari reaksi tertentu.
KSP adalah singkatan dari Solubility Product Constant sementara KEQ adalah singkatan dari Equilibrium Constant. KSP juga merupakan jenis konstanta kesetimbangan, tetapi hanya berurusan dengan kelarutan zat padat. Keq adalah istilah yang lebih umum yang dapat kita gunakan untuk menentukan sifat dari semua jenis keseimbangan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu KSP
3. Apa itu keq
4. Perbandingan berdampingan - ksp vs keq dalam bentuk tabel
5. Ringkasan
Apa itu KSP
KSP adalah singkatan dari Konstanta produk kelarutan. Ini berlaku untuk pembubaran zat padat dalam larutan berair. Konstanta ini menggambarkan tingkat di mana zat kimia larut dalam larutan berair. Lebih tinggi kelarutan, semakin tinggi nilai KSP. Untuk reaksi kelarutan umum, kami dapat memberikan persamaan untuk KSP sebagai berikut:
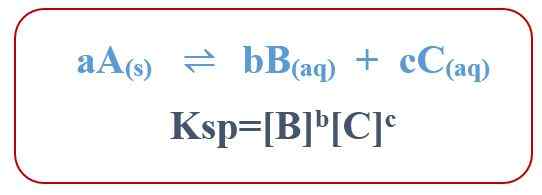
Oleh karena itu, konstanta produk kelarutan berasal dari perkalian konsentrasi molar produk yang kita dapatkan dari pembubaran zat padat. Namun, jika ada hubungan stoikiometrik antara reaktan dan produk, kita harus memasukkan koefisien stoikiometrik dalam persamaan kita. Perlu untuk meningkatkan konsentrasi produk ke daya koefisien.
Efek ion umum:
Kita harus selalu ingat bahwa kelarutan reaksi kesetimbangan dikurangi oleh efek ion umum. Misalnya, jika ada ion umum dalam larutan dan senyawa padat kita akan larut dalam larutan itu, kita dapat mengamati KSP yang lebih rendah dari yang diharapkan. Tanpa ion itu, KSP akan menjadi nilai besar.
Efek garam:
Kehadiran ion yang tidak umum dalam larutan juga dapat mempengaruhi KSP dari keseimbangan. Misalnya, jika ada ion garam dalam larutan selain ion yang ada di padatan, maka kami menyebutnya ion yang tidak umum, dan dapat meningkatkan nilai KSP.
Apa itu keq?
Keq adalah singkatan dari Equilibrium Constant. Konstanta kesetimbangan adalah rasio antara konsentrasi produk dan konsentrasi reaktan pada keseimbangan. Istilah ini hanya berlaku untuk reaksi yang berada dalam keseimbangan. Konstanta reaksi reaksi dan konstanta keseimbangan adalah sama untuk reaksi yang berada dalam keseimbangan.
Kita dapat memberikan konstanta keseimbangan sebagai konsentrasi yang diangkat ke kekuatan koefisien stoikiometrik. Konstanta kesetimbangan tergantung pada suhu sistem yang dipertimbangkan karena suhu mempengaruhi kelarutan komponen dan ekspansi volume. Namun, persamaan untuk konstanta kesetimbangan tidak termasuk rincian tentang padatan yang termasuk di antara reaktan atau produk. Hanya zat dalam fase cair dan fase gas yang dipertimbangkan.
Sebagai contoh, mari kita pertimbangkan keseimbangan antara asam karbonat dan ion bikarbonat.
H2BERSAMA3 (aq) ↔ hco3-(aq) + H+ (aq)
Konstanta kesetimbangan untuk reaksi di atas diberikan di bawah ini.
Equilibrium Constant (k) = [HCO3-(aq)] [H+ (aq)] / [H2BERSAMA3 (aq)]
Apa perbedaan antara KSP dan Keq?
KSP adalah jenis keq. KSP adalah singkatan dari Solubility Product Constant sementara KEQ adalah singkatan dari Equilibrium Constant. Perbedaan utama antara KSP dan KEQ adalah bahwa istilah KSP menggambarkan kelarutan suatu zat, sedangkan istilah keq menggambarkan keadaan keseimbangan dari reaksi tertentu. Saat mempertimbangkan persamaan, KSP hanya memiliki produk yang kami dapatkan setelah pembubaran padatan sementara KEQ berisi produk dan reaktan yang berada dalam keadaan berair. Jadi, ini adalah perbedaan signifikan lainnya antara KSP dan Keq.

Ringkasan -KSP vs Keq
KSP adalah jenis keq. KSP adalah singkatan dari Solubility Product Constant sementara KEQ adalah singkatan dari Equilibrium Constant. Perbedaan utama antara KSP dan KEQ adalah bahwa istilah KSP menggambarkan kelarutan suatu zat, sedangkan istilah keq menggambarkan keadaan keseimbangan dari reaksi tertentu.
Referensi:
1. “Konstanta produk kelarutan, KSP." Libreteks Kimia, Libretexts, 5 Juni 2019, tersedia di sini.


