Perbedaan antara KSP dan QSP
Perbedaan Utama - KSP vs Qsp
KSP adalah konstanta produk kelarutan dan QSP adalah kecenderungan produk kelarutan. Itu perbedaan utama Antara KSP dan QSP adalah itu KSP menunjukkan kelarutan suatu zat sedangkan QSP menunjukkan keadaan solusi saat ini. Produk kelarutan adalah produk konsentrasi spesies ionik yang ada dalam larutan ketika suatu zat dilarutkan dalam pelarut seperti air.
Produk kelarutan ditentukan saat larutan jenuh dengan zat itu. Kelarutan produksion produk adalah produk dari konsentrasi spesies ionik dalam suatu larutan kapan saja; sebelum saturasi atau setelah larutan jenuh. Kadang -kadang dikenal sebagai produk ionik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu KSP
3. Apa itu QSP
4. Hubungan antara KSP dan QSP
5. Perbandingan berdampingan - ksp vs qsp dalam bentuk tabel
6. Ringkasan
Apa itu KSP?
KSP adalah konstanta produk kelarutan dari zat tertentu. Ini menunjukkan kelarutan suatu zat (berapa banyak padatan yang dilarutkan dalam suatu larutan). Konstanta produk kelarutan diberikan untuk larutan yang jenuh dengan zat. Lebih tinggi KSP, lebih tinggi kelarutan zat itu. Produk kelarutan diberikan sebagai produk konsentrasi spesies ionik dalam suatu larutan.
Solusi jenuh muncul dengan kekeruhan yang menunjukkan awal pembentukan endapan. Itu adalah bentuk zat terlarut yang tidak larut. Bagian cair dari sistem itu memiliki zat terlarut terlarut. KSP dari solusi tersebut mewakili keseimbangan antara bentuk yang larut dan tidak larut ini.
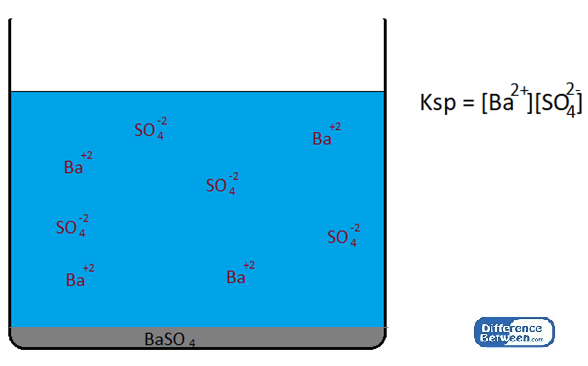
Faktor -faktor yang mempengaruhi nilai konstanta produk kelarutan adalah suhu, adanya ion umum, pH atau keasaman, dll. Saat suhu meningkat, kelarutan endapan padat juga meningkat. Kemudian produk konsentrasi spesies ionik meningkat, menghasilkan nilai tinggi konstanta produk kelarutan. Kehadiran ion umum dijelaskan oleh efek ion umum. Ketika ion umum hadir, KSP berkurang. Ion umum berarti salah satu spesies ionik yang sudah ada dalam solusi itu. Misalnya, untuk sistem kesetimbangan yang mengandung endapan baso4 (barium sulfat) bersama dengan, BA+2 ion dan sebagainya42- ion, penambahan salah satu BA+2 atau lebih42- ion dapat mempengaruhi keseimbangan.
Baso4 (s)↔ ba+2(aq) + JADI42-(aq)

Gambar 01: KSP dari larutan jenuh BASO4
Ketika salah satu ion ini ditambahkan dari sumber eksternal, maka keseimbangan di atas bergeser ke sisi kiri (bentuk zat yang lebih tidak larut terbentuk mengurangi jumlah ion yang ada dalam larutan), mengurangi kelarutan zat tersebut.
Apa itu QSP?
QSP adalah hasil bagi kelarutan dari suatu solusi. Itu menggambarkan keadaan solusi saat ini. Ini berarti QSP diberikan untuk larutan tak jenuh (sebelum saturasi), jenuh atau jenuh. QSP juga disebut produk ion karena merupakan produk konsentrasi spesies ionik setiap saat (tidak pada saat tertentu seperti saturasi). Oleh karena itu, KSP (konstanta produk kelarutan) adalah bentuk khusus dari QSP.
Apa hubungan antara KSP dan QSP?
- Jika nilai QSP kurang dari KSP untuk suatu zat dalam larutan, lebih banyak padatan dapat dilarutkan dalam larutan itu.
- Saat QSP dan KSP memiliki nilai yang sama, maka solusinya menjadi jenuh.
- Jika QSP lebih tinggi dari nilai KSP, endapan terbentuk.
Apa perbedaan antara KSP dan QSP?
KSP vs QSP | |
| KSP adalah konstanta produk kelarutan dari zat tertentu. | QSP adalah hasil bagi kelarutan dari suatu solusi. |
| Alam | |
| KSP adalah nilai keseimbangan. | QSP bukan nilai keseimbangan. |
| Keadaan solusinya | |
| KSP adalah produk konsentrasi spesies ionik dalam larutan jenuh. | QSP adalah produk konsentrasi spesies ionik dalam larutan tak jenuh, jenuh atau tak jenuh. |
Ringkasan - Ksp vs Qsp
KSP dan QSP adalah istilah yang sangat terkait dalam kimia. KSP didefinisikan sebagai larutan jenuh yang memiliki keseimbangan antara spesies ionik dan endapan padat (momen di mana pembentukan endapan telah dimulai). QSP diberikan untuk setiap saat (tidak ditentukan); sebelum saturasi atau setelah saturasi. Perbedaan antara KSP dan QSP adalah bahwa KSP adalah konstanta produk kelarutan sedangkan QSP adalah kecenderungan produk kelarutan.


