Perbedaan antara multiplisitas dan urutan obligasi
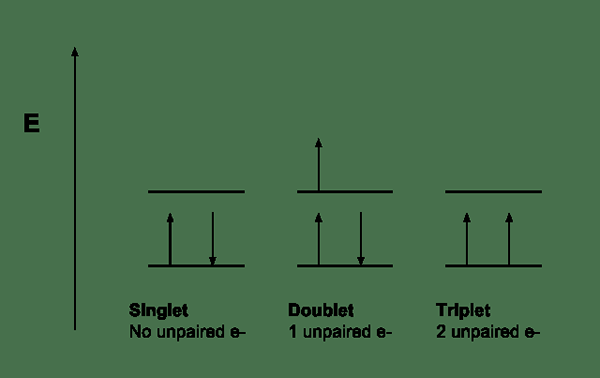
Itu perbedaan utama Antara multiplisitas dan urutan obligasi adalah itu Multiplisitas mengacu pada jumlah orientasi yang mungkin dari putaran tingkat energi, sedangkan urutan ikatan mengacu pada pengukuran jumlah elektron dalam ikatan kimia.
Multiplisitas dan urutan ikatan adalah sifat senyawa kimia. Konsep multiplisitas penting dalam kimia kuantum, sedangkan konsep urutan ikatan penting dalam dinamika molekuler.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu multiplisitas
3. Apa urutan obligasi
4. Perbandingan berdampingan - multiplisitas vs urutan ikatan dalam bentuk tabel
5. Ringkasan
Apa itu multiplisitas?
Multiplisitas mengacu pada jumlah orientasi yang mungkin dari putaran tingkat energi. Konsep ini berguna dalam spektroskopi dan mekanika kuantum. Persamaan untuk pengukuran multiplisitas adalah 2S+1 di mana "S" mengacu pada momentum sudut putaran total. Nilai -nilai yang dapat kita peroleh untuk multiplisitas termasuk 1, 2, 3, 4 ... kita dapat menyebutkannya sebagai singlet, doublet, kembar tiga, kuartet, dll.

Multiplisitas diukur relatif terhadap momentum sudut orbital. Itu berarti; Ini diukur relatif terhadap jumlah tingkat energi yang hampir merosot, yang berbeda satu sama lain sesuai dengan energi interaksi orbit spin-orbit. Misalnya, senyawa organik yang stabil memiliki cangkang elektron lengkap yang tidak memiliki elektron yang tidak berpasangan. Oleh karena itu, molekul -molekul ini memiliki singlet, keadaan dasar.
Apa urutan obligasi?
Urutan ikatan mengacu pada pengukuran jumlah elektron dalam ikatan kimia. Konsep tatanan ikatan dikembangkan oleh Linus Pauling. Ini berguna sebagai indikator stabilitas ikatan kimia. Lebih tinggi nilai urutan obligasi, lebih kuat ikatan kimia. Jika tidak ada orbital antibonding, urutan ikatan sama dengan jumlah ikatan antara dua atom molekul. Ini karena urutan ikatan kemudian sama dengan jumlah elektron ikatan dibagi dua (ikatan kimia memiliki dua elektron per obligasi). Persamaan untuk perhitungan urutan ikatan dalam molekul tertentu adalah sebagai berikut:
Pesanan Bond = (Jumlah Elektron Ikatan - Jumlah Elektron Antibonding)/2
Menurut persamaan di atas, jika urutan ikatan nol, kedua atom tidak terikat satu sama lain. Misalnya, urutan ikatan untuk molekul dinitrogen adalah 3. Selain itu, spesies isoelektronik biasanya memiliki urutan ikatan yang sama. Selain itu, konsep urutan ikatan berguna dalam dinamika molekuler dan potensi urutan ikatan.
Apa perbedaan antara multiplisitas dan urutan obligasi?
Konsep multiplisitas penting dalam kimia kuantum, sedangkan konsep urutan ikatan penting dalam dinamika molekuler. Perbedaan utama antara multiplisitas dan urutan ikatan adalah bahwa multiplisitas mengacu pada jumlah orientasi yang mungkin dari putaran tingkat energi, sedangkan urutan ikatan mengacu pada pengukuran jumlah elektron dalam ikatan kimia.
Persamaan untuk penentuan multiplisitas adalah 2s+1 di mana s adalah momentum sudut putaran total. Persamaan untuk penentuan urutan ikatan adalah (elektron ikatan + elektron antibonding)/2. Selain itu, multiplisitas diukur sebagai nilai relatif (yang relatif terhadap momentum sudut orbital). Tapi, urutan obligasi adalah nilai tertentu untuk ikatan kimia tertentu. Biasanya, jika urutan ikatan nol, itu berarti tidak ada ikatan kimia.
Di bawah infografis merangkum perbedaan antara multiplisitas dan urutan obligasi.
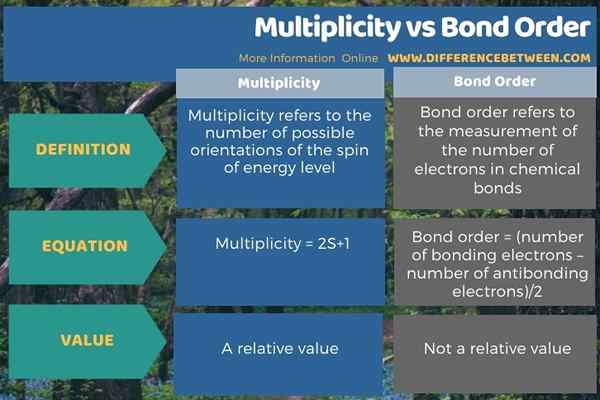
Ringkasan -multiplisitas vs urutan obligasi
Konsep multiplisitas penting dalam kimia kuantum, sedangkan konsep urutan ikatan penting dalam dinamika molekuler. Perbedaan utama antara multiplisitas dan urutan ikatan adalah bahwa multiplisitas mengacu pada jumlah orientasi yang mungkin dari putaran tingkat energi sedangkan urutan ikatan mengacu pada pengukuran jumlah elektron dalam ikatan kimia.
Referensi:
1. Helmenstine, Anne Marie. “Definisi dan contoh pesanan ikatan."Thoughtco, Nov. 5, 2019, tersedia di sini.
Gambar milik:
1. “Spin Multiplicity Diagram” oleh Lightex - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


