Perbedaan antara oksidasi dan reduksi
Itu perbedaan utama antara oksidasi dan reduksi adalah itu Oksidasi mengacu pada hilangnya elektron saat reduksi mengacu pada gain elektron.
Reaksi kimia antara senyawa yang berbeda disebut reaksi redoks jika keadaan oksidasi reaktan berbeda dari produk dari produk. Redoks kependekan dari reduksi-oksidasi, yang terjadi pada reaksi kimia apa pun. Sementara oksidasi mengacu pada hilangnya elektron, pengurangan adalah tempat mendapatkan kembali elektron terjadi. Reaksi ini bisa sederhana atau kompleks, tergantung pada proses dan atom yang terlibat.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu oksidasi
3. Apa itu pengurangan
4. Perbandingan berdampingan - oksidasi vs pengurangan dalam bentuk tabel
5. Ringkasan
Apa itu oksidasi?
Oksidasi dapat digambarkan sebagai peningkatan jumlah oksidasi. Oleh karena itu, oksidasi dapat didefinisikan sebagai hilangnya elektron dari atom, molekul atau ion. Hilangnya elektron ini menyebabkan keadaan oksidasi spesies kimia meningkat. Karena reaksi oksidasi melepaskan elektron, harus ada spesies yang menerima elektron. Oleh karena itu, reaksi oksidasi adalah reaksi setengah dari reaksi utama. Oksidasi spesies kimia diberikan sebagai perubahan keadaan oksidasi. Keadaan oksidasi adalah angka dengan simbol positif (+) atau negatif (-), yang menunjukkan kehilangan atau gain elektron dengan atom, molekul atau ion tertentu.

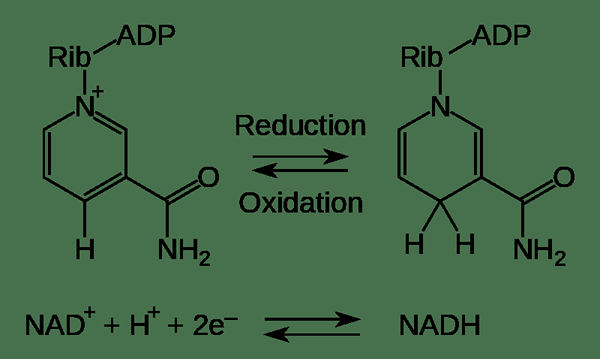
Gambar 01: Contoh dua reaksi setengah: oksidasi dan reduksi
Di masa lalu, istilah oksidasi diberikan definisi “penambahan oksigen ke senyawa.“Ini karena oksigen adalah satu -satunya agen pengoksidasi yang diketahui saat itu. Namun, definisi ini tidak lagi akurat karena ada lebih banyak reaksi oksidasi yang terjadi tanpa adanya oksigen. Sebagai contoh, reaksi antara magnesium (Mg) dan asam klorida (HCl) tidak melibatkan oksigen, tetapi itu adalah reaksi redoks yang mencakup oksidasi mg menjadi mg2+.
Apa itu pengurangan?
Pengurangan dapat digambarkan sebagai penurunan angka oksidasi. Oleh karena itu, kita dapat mendefinisikan reduksi sebagai gain elektron dari atom, molekul, atau ion. Keuntungan elektron ini menyebabkan keadaan oksidasi spesies kimia berkurang. Karena reaksi reduksi memperoleh elektron, harus ada spesies yang menyumbang elektron. Oleh karena itu, reaksi reduksi adalah reaksi setengah dari reaksi utama. Pengurangan spesies kimia diberikan sebagai perubahan keadaan oksidasi.
Di masa lalu, istilah reduksi diberikan definisi “Penghapusan oksigen dari senyawa.“Ini karena oksigen adalah satu -satunya agen pengoksidasi yang diketahui saat itu. Namun, definisi ini tidak lagi akurat karena ada lebih banyak reaksi oksidasi yang terjadi tanpa adanya oksigen.
Apa perbedaan antara oksidasi dan reduksi?
Reduksi dan oksidasi adalah proses kimia yang terlibat dalam setiap reaksi kimia. Ini adalah dua reaksi yang berlawanan. Perbedaan utama antara oksidasi dan reduksi adalah bahwa oksidasi mengacu pada hilangnya elektron sementara reduksi mengacu pada gain elektron. Sementara oksidasi meningkatkan nilai tanda positif (+), reduksi meningkatkan nilai tanda negatif (-).
Ringkasan -oksidasi vs pengurangan
Reduksi dan oksidasi adalah proses kimia yang terlibat dalam setiap reaksi kimia. Perbedaan utama antara oksidasi dan reduksi adalah bahwa oksidasi mengacu pada hilangnya elektron sementara reduksi mengacu pada gain elektron.
Referensi:
1. Helmenstine, Anne Marie. “Definisi dan contoh oksidasi dalam kimia."Thoughtco, Feb. 12, 2020, tersedia di sini.
2. Helmenstine, Anne Marie. “Definisi reduksi dalam kimia."Thoughtco, Feb. 11, 2020, tersedia di sini.
Gambar milik:
1. “NAD Oxidation Reduction” oleh Fvasconcellos 19:44, 9 Desember 2007 (UTC). W: Gambar: Pengurangan oksidasi NAD.PNG oleh Tim Vickers. - Versi vektor W: Gambar: Pengurangan oksidasi NAD.PNG oleh Tim Vickers (domain publik) via Commons Wikimedia