Perbedaan antara reaksi fotokimia dan elektrokimia
Itu perbedaan utama Antara reaksi fotokimia dan elektrokimia adalah itu Reaksi fotokimia terjadi karena penyerapan energi cahaya, sedangkan reaksi elektrokimia terjadi karena penyerapan energi listrik.
Reaksi fotokimia dan reaksi elektrokimia adalah dua jenis reaksi kimia yang terjadi di hadapan dua sumber energi yang berbeda. Namun, kedua reaksi ini sering kali merupakan reaksi endotermik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu reaksi fotokimia
3. Apa itu reaksi elektrokimia
4. Perbandingan berdampingan - reaksi fotokimia vs elektrokimia dalam bentuk tabel
5. Ringkasan
Apa itu reaksi fotokimia?
Reaksi fotokimia adalah jenis reaksi kimia yang diprakarsai oleh penyerapan energi dalam bentuk cahaya. Dan, penyerapan energi molekul ini mengarah pada penciptaan keadaan tereksitasi sementara yang sifat kimianya dan fisik sangat berbeda dari keadaan asli molekul. Spesies kimia yang baru terbentuk berbeda dari keadaan awal dengan mengubah ke struktur baru (melalui menggabungkan satu sama lain atau molekul lain, melalui transfer elektron, atom hidrogen, proton, dll.
Jika dibandingkan dengan keadaan asli molekul, keadaan tereksitasi memiliki sifat asam yang kuat, dan itu adalah reduktor yang lebih kuat dari keadaan aslinya. Selain itu, dalam proses fotokimia paling sederhana, keadaan tereksitasi cenderung memancarkan cahaya dalam bentuk fluoresensi.

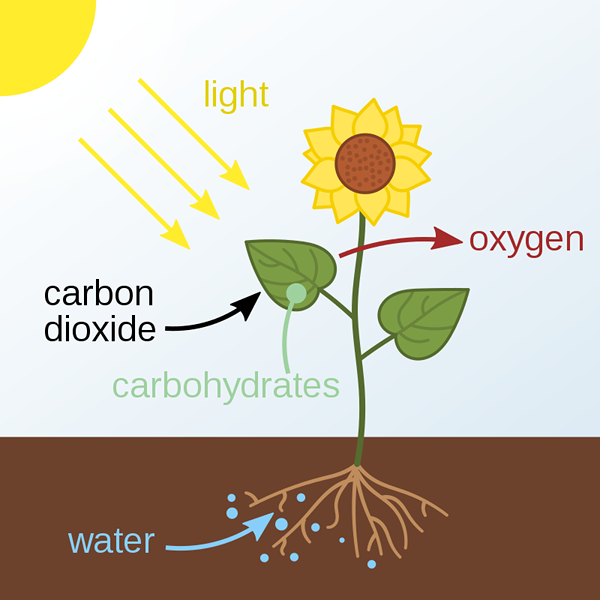
Gambar 01: Fotosintesis
Proses fotokimia yang paling umum di Bumi adalah fotosintesis. Kehidupan di Bumi terutama tergantung pada proses fotosintesis. Dalam proses ini, tanaman dapat mengubah energi dari sinar matahari menjadi energi kimia yang disimpan melalui pembentukan karbohidrat (menggunakan karbon dioksida dan air dari atmosfer). Juga, proses ini melepaskan oksigen ke atmosfer. Karena sebagian besar sinar matahari mencapai atmosfer bumi, sebagian besar proses yang terjadi di bumi adalah reaksi fotokimia.
Apa itu reaksi elektrokimia?
Reaksi elektrokimia adalah jenis reaksi kimia yang disertai dengan lintasan arus listrik. Sebagian besar, jenis reaksi ini melibatkan transfer elektron antara dua zat (satu zat adalah padatan, dan zat lainnya adalah cairan).
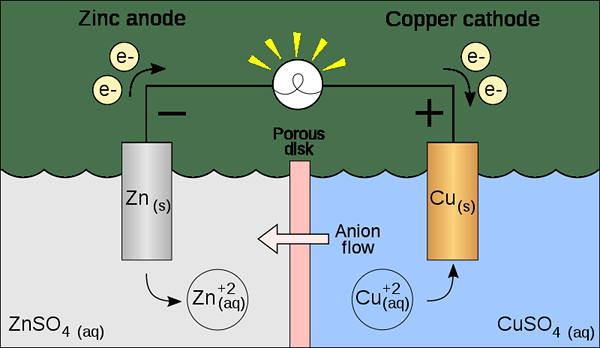
Gambar 02: Sel Listrik
Secara umum, terjadinya reaksi kimia terjadi dengan pembebasan atau penyerapan panas (bukan bentuk energi lainnya). Tapi, mungkin ada banyak reaksi lain yang melanjutkan kontak dengan konduktor elektronik, dipisahkan dengan melakukan kabel. Juga, proses ini melepaskan energi listrik di mana arus listrik dihasilkan. Dan, energi listrik ini dapat digunakan untuk melakukan reaksi kimia dengan menggunakan energi sebagai sumber energi.
Sistem paling umum yang kita tahu yang menggunakan energi listrik untuk menghasilkan reaksi kimia adalah sel listrik. Di sini, elektrolisis menyebabkan konversi satu zat kimia menjadi zat yang berbeda dengan ikatan pemecahan dan pembentukan ikatan.
Apa perbedaan antara reaksi fotokimia dan elektrokimia?
Reaksi fotokimia dan elektrokimia adalah reaksi kimia yang terjadi di bawah pengaruh dua sumber energi yang berbeda. Perbedaan utama antara reaksi fotokimia dan elektrokimia adalah bahwa reaksi fotokimia terjadi karena penyerapan energi cahaya, sedangkan reaksi elektrokimia terjadi karena penyerapan energi listrik.
Tabulasi di bawah ini menyajikan lebih banyak detail perbedaan antara reaksi fotokimia dan elektrokimia.

Ringkasan -reaksi fotokimia vs elektrokimia
Reaksi fotokimia dan elektrokimia adalah reaksi kimia yang terjadi di hadapan dua sumber energi yang berbeda. Perbedaan utama antara reaksi fotokimia dan elektrokimia adalah bahwa reaksi fotokimia terjadi karena penyerapan energi cahaya, sedangkan reaksi elektrokimia terjadi karena penyerapan energi listrik.
Referensi:
1. Bockris, John O'M., dan Aleksandar r. Despić. “Reaksi elektrokimia." Encyclopædia Britannica, Encyclopædia Britannica, Inc., 15 Des. 2011, tersedia di sini.
Gambar milik:
1. “Photosynthesis EN” oleh AT09KG: Wattcle Asli: Grafik Vektor - File ini berasal dari fotosintesis.gif:, (cc by-sa 4.0) Via Commons Wikimedia
2. “Sel galvanik tanpa aliran kation” oleh !Asli: OhiostDardVector: Anticompositenumber - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


