Perbedaan antara pelarut protik dan aprotik

Perbedaan Utama - Protik vs Aprotik Pelarut
Itu perbedaan utama Antara pelarut protik dan aprotik adalah itu pelarut protik memiliki atom hidrogen yang dapat dipisahkan sedangkan pelarut aprotik tidak memiliki atom hidrogen yang dapat dipisahkan.
Pelarut adalah senyawa cair yang dapat melarutkan zat lain. Ada berbagai bentuk pelarut yang dapat dikategorikan pada dasarnya menjadi dua kelompok sebagai pelarut polar dan nonpolar. Pelarut kutub dapat dibagi menjadi dua kelompok sebagai pelarut protik dan aprotik. Pelarut protik dapat membentuk ikatan hidrogen karena mereka memiliki ikatan kimia yang diperlukan untuk ikatan hidrogen, i.e. Obligasi O-H dan N-H Bond. Sebaliknya, pelarut aprotik tidak memiliki ikatan kimia yang diperlukan untuk ikatan hidrogen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu pelarut protik
3. Apa itu pelarut aprotik
4. Kesamaan antara pelarut protik dan aprotik
5. Perbandingan berdampingan - pelarut protik vs aprotik dalam bentuk tabel
6. Ringkasan
Apa itu pelarut protik?
Pelarut protik adalah senyawa cairan kutub yang memiliki atom hidrogen yang dapat dipisahkan. Pelarut ini memiliki banyak ikatan O-H dan obligasi N-H. Atom hidrogen yang dapat dipisahkan adalah yang terikat pada atom oksigen dan atom nitrogen dalam ikatan O-H dan N-H ini. Oleh karena itu, gugus hidroksil (-OH) dan kelompok amina (-nh2) adalah komponen penting dalam pelarut protik.
Pelarut protik berbagi daya larut ion dengan pelarut aprotik dan bersifat asam (karena mereka dapat melepaskan proton). Konstanta dielektrik dari pelarut protik ini sangat tinggi (konstanta dielektrik adalah sifat bahan isolasi listrik dan merupakan kuantitas yang mengukur kemampuan suatu zat untuk menyimpan energi listrik dalam medan listrik).
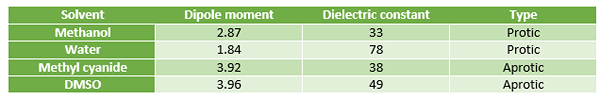
Contoh pelarut protik termasuk air, alkohol seperti metanol dan etanol, hidrogen fluoride (HF), dan amonia (NH3). Pelarut ini sering digunakan untuk melarutkan garam. Pelarut protik polar lebih suka menjalani reaksi SN1.
Apa itu pelarut aprotik?
Pelarut aprotik adalah senyawa cair polar yang tidak memiliki atom hidrogen yang terpisah. Pelarut ini kekurangan tubuh kimia seperti ikatan O-H dan ikatan N-H. Oleh karena itu, pelarut aprotik kekurangan gugus hidroksil (-OH) dan kelompok amina (-NH2) dan tidak dapat membentuk ikatan hidrogen.
Pelarut aprotik berbagi daya larut ion dengan pelarut protik. Pelarut aprotik ini kekurangan hidrogen asam, sehingga tidak ada pelepasan ion hidrogen yang cukup besar. Pelarut aprotik polar memiliki nilai konstan dielektrik rendah atau menengah. Pelarut ini menunjukkan polaritas sedang.
Gambar 01: Perbandingan antara pelarut protik dan aprotik
Contoh pelarut aprotik termasuk diklorometana (DCM), tetrahydrofuran (THF), etil asetat, dan aseton. Pelarut aprotik dapat digunakan untuk melarutkan garam. Pelarut ini lebih suka menjalani reaksi SN2.
Apa kesamaan antara pelarut protik dan aprotik?
- Pelarut protik dan aprotik adalah pelarut polar.
- Pelarut pelarut protik dan aprotik dapat melarutkan garam.
Apa perbedaan antara pelarut protik dan aprotik?
Pelarut protik vs aprotik | |
| Pelarut protik adalah senyawa cairan kutub yang memiliki atom hidrogen yang dapat dipisahkan. | Pelarut aprotik adalah senyawa cair polar yang tidak memiliki atom hidrogen yang terpisah. |
| Pembentukan ikatan hidrogen | |
| Pelarut protik mampu melakukan pembentukan ikatan hidrogen. | Pelarut aprotik tidak dapat membentuk ikatan hidrogen. |
| Keasaman | |
| Pelarut protik bersifat asam. | Pelarut aprotik tidak asam. |
| Obligasi Kimia Hadir | |
| Pelarut protik kaya dengan ikatan O-H dan ikatan N-H. | Pelarut aprotik kekurangan ikatan O-H dan ikatan N-H. |
| Konstanta dielektrik | |
| Pelarut protik memiliki konstanta dielektrik yang tinggi. | Pelarut aprotik memiliki konstanta dielektrik rendah. |
| Jenis reaksi yang disukai | |
| Pelarut protik lebih suka menjalani reaksi SN1. | Pelarut aprotik lebih suka menjalani reaksi SN2. |
Ringkasan -Protik vs Aprotik Pelarut
Pelarut adalah cairan yang mampu melarutkan zat. Pelarut dapat ditemukan dalam dua bentuk utama sebagai pelarut polar dan pelarut nonpolar. Pelarut polar dapat lagi dibagi menjadi dua kelompok sebagai pelarut protik dan pelarut aprotik. Perbedaan antara pelarut protik dan aprotik adalah bahwa pelarut protik memiliki atom hidrogen yang dapat dipisahkan sedangkan pelarut aprotik tidak memiliki atom hidrogen yang dapat dipisahkan.
Referensi:
1.“Protik Kutub? Aprotik kutub? Nonpolar? Semua tentang pelarut.”Master Organic Chemistry RSS. Tersedia disini
2.“Pelarut protik."Wikipedia, Wikimedia Foundation, 17 Des. 2017. Tersedia disini
3.“Pelarut aprotik dan protik.”Scribd, Scribd. Tersedia disini


