Perbedaan antara orbital murni dan hibrida
Itu perbedaan utama antara orbital murni dan hibrida adalah bahwa Orbital murni adalah orbital atom asli sedangkan orbital hibrida terbentuk dari pencampuran dua atau lebih orbital atom.
Dalam pembentukan ikatan kimia dari molekul sederhana, kita dapat dengan mudah mempertimbangkan tumpang tindih orbital atom. Tetapi jika kita ingin membahas ikatan kimia dalam molekul kompleks, kita perlu tahu apa itu hibridisasi orbital. Hibridisasi orbital adalah konsep kimia yang menggambarkan pencampuran orbital atom untuk membentuk orbital hibrida baru. Orbital ini terlibat dalam pembentukan ikatan kimia kovalen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu orbital murni
3. Apa itu orbital hibrida
4. Perbandingan berdampingan - Orbital hibrida vs murni dalam bentuk tabel
5. Ringkasan
Apa itu orbital murni?
Orbital murni adalah orbital atom yang mengandung elektron atom. Orbital ini bukan orbital campuran seperti orbital hibrida. Orbital memberikan lokasi elektron yang paling mungkin dalam atom karena elektron dalam gerakan terus menerus di sekitar nukleus atom. Daripada lokasi yang tetap, ini memberikan wilayah di mana elektron dapat terjadi pada waktu tertentu.
Orbital atom murni ada dalam beberapa bentuk seperti bentuk bola, bentuk dumbbell. Menurut mekanika kuantum, ada satu set angka kuantum yang kami gunakan untuk memberi nama orbital. Set angka ini termasuk N (angka kuantum utama), L (angka momentum sudut), m (angka kuantum magnetik) dan S (nomor kuantum spin). Setiap orbital menempati maksimal dua elektron. Menurut bilangan kuantum momentum sudut, ada empat orbital atom yang umum diketahui sebagai orbital (berbentuk bulat), orbital p (berbentuk dumbel), d orbital (dua dumbbell di bidang yang sama) dan f orbital (struktur yang rumit).
Apa itu orbital hibrida?
Orbital hibrida adalah orbital molekul yang terbentuk dari pencampuran orbital atom. Ini adalah orbital hipotetis. Pencampuran terjadi antara orbital atom dari atom yang sama. Pencampuran ini terjadi untuk membentuk ikatan kimia kovalen dengan atom lain. Proses pencampuran ini adalah "hibridisasi orbital" yang menghasilkan orbital hibrida. Kami menamai orbital ini sesuai dengan orbital atom yang mengalami hibridisasi.

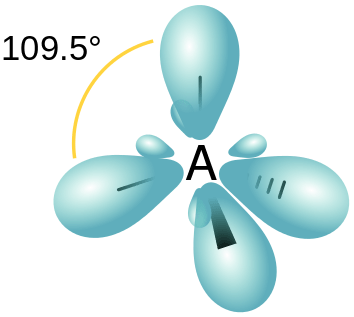
Gambar 01: Hibridisasi SP3
Dengan demikian, tiga bentuk utama orbital hibrida adalah:
- SP Hybrid Orbital - ini terbentuk karena hibridisasi orbital atom S dan P. Oleh karena itu orbital hibrida yang dihasilkan memiliki karakteristik 50% s dan karakteristik orbital 50% p. Orbital hibrida ini memiliki pengaturan spasial linier.
- sp2 Orbital hibrida - ini terbentuk karena hibridisasi satu s dan dua orbital P. Oleh karena itu orbital hibrida yang dihasilkan memiliki 33% karakteristik orbital S dan 66% dari karakteristik orbital P. Pengaturan spasial adalah trigonal planar.
- sp3 Orbital hibrida - ini terbentuk karena hibridisasi satu s dan tiga p orbital. Oleh karena itu orbital hibrida yang dihasilkan memiliki karakteristik 25% s dan karakteristik P 75%. Susunan spasial orbital hibrida ini adalah tetrahedral.
Apa perbedaan antara orbital murni dan hibrida?
Orbital murni adalah orbital atom yang mengandung elektron atom sedangkan orbital hibrida adalah orbital molekul yang terbentuk dari pencampuran orbital atom. Ini adalah perbedaan utama antara orbital murni dan hibrida. Selain itu, orbital hibrida terbentuk melalui hibridisasi orbital, tetapi orbital murni tidak dihidridisasi. Selain itu, pembentukan orbital hibrida penting dalam pembentukan senyawa kimia yang rumit melalui pembentukan ikatan kimia kovalen. Saat mempertimbangkan nomenklatur orbital, kami menyebutkan orbital murni sebagai orbital s, p, d dan f saat kami menyebutkan orbital hibrida sebagai sp, sp sp, sp sp, sp2, sp3, dll.
Infografis di bawah ini tabulasi perbedaan antara orbital murni dan hibrida untuk referensi cepat.
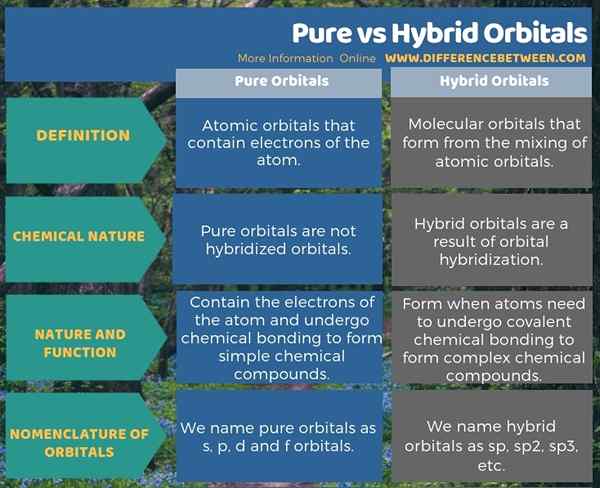
Ringkasan -Orbital Hibrida Pure Vs
Orbital atom adalah daerah di mana elektron ada dalam atom. Dalam artikel ini, kami menggambarkan dua jenis orbital sebagai orbital murni dan hibrida. Perbedaan utama antara orbital murni dan hibrida adalah bahwa orbital murni adalah orbital atom asli sedangkan orbital hibrida terbentuk dari pencampuran dua atau lebih orbital atom.
Referensi:
1. Libretexts. “Orbital hibrida.”Kimia Libretexts, Libretexts, 21 Juli 2016. Tersedia disini
Gambar milik:
1."AE4H" oleh JFMelero - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


