Perbedaan antara keasaman dan basa

Perbedaan utama - Keasaman vs Basa
Keasaman dan kebesaran senyawa adalah indikasi pH. Keasaman suatu media disebabkan oleh senyawa asam, yang dapat melepaskan ion hidrogen (H+), menghasilkan pH rendah di media itu. Basisitas suatu media disebabkan oleh senyawa dasar, yang dapat melepaskan ion hidroksida (OH-), menghasilkan pH tinggi di media itu. Perbedaan utama antara keasaman dan kesederhanaan adalah itu Keasaman menyebabkan pH rendah sedangkan kebangsa menyebabkan pH tinggi dalam media berair.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu keasaman
3. Apa itu Basa
4. Perbandingan berdampingan - Keasaman vs Basa dalam bentuk tabel
5. Ringkasan
Apa itu keasaman?
Keasaman adalah kadar asam dalam zat. Konsentrasi ion hidrogen (h+) adalah parameter utama yang digunakan untuk mengidentifikasi keasaman. Konsentrasi ion hidrogen dinyatakan sebagai nilai pH. pH adalah logaritma negatif dari konsentrasi ion hidrogen. Oleh karena itu, lebih tinggi konsentrasi ion hidrogen, menurunkan pH. Nilai pH rendah menunjukkan keasaman yang lebih tinggi.
Menurut keasaman zat, ada dua jenis asam sebagai asam kuat dan asam lemah. Asam kuat menyebabkan tingkat keasaman yang lebih tinggi dalam media berair sedangkan asam lemah menghasilkan keasaman rendah. Asam kuat dapat sepenuhnya terdisosiasi menjadi ion, melepaskan semua ion hidrogen yang mungkin (h+). Sebaliknya, asam lemah sebagian terdisosiasi, hanya melepaskan beberapa ion hidrogen. Asam juga dapat dikategorikan sebagai asam monoprotik dan asam poliprotik; Asam monoprotik melepaskan satu ion hidrogen per molekul sedangkan asam poliprotik melepaskan lebih banyak ion hidrogen per molekul.
Keasaman asam ditentukan oleh pKa asam. PKA adalah logaritma negatif KA. Ka adalah konstanta disosiasi asam dari suatu larutan. Ini adalah pengukuran kuantitatif kekuatan asam dalam larutan (atau keasaman). Turunkan pKa, semakin kuat asam. Lebih tinggi pKa, semakin lemah asam.

Gambar 01: Jus lemon memiliki keasaman tinggi
Tren berkala keasaman elemen kimia pada dasarnya tergantung pada nilai elektronegativitasnya.Elektronegativitas elemen kimia meningkat dari kiri ke kanan periode. Jika elektronegativitas atom lebih tinggi, ia dapat menstabilkan atom negatif dengan sangat mudah karena memiliki afinitas yang lebih tinggi untuk elektron. Oleh karena itu, ion hidrogen yang terkait dengan atom elektronegatif yang tinggi mudah dilepaskan daripada atom elektronegatif rendah, menghasilkan keasaman yang lebih tinggi. Saat turun kelompok dalam tabel periodik, keasaman meningkat. Ini karena ukuran atom meningkat di kelompok. Atom besar dapat menstabilkan muatan negatif pada mereka (dengan distribusi muatan); karenanya ion hidrogen yang terkait dengan atom besar dapat dengan mudah dilepaskan.
Apa itu Basa?
Basisitas suatu zat adalah jumlah atom hidrogen yang dapat diganti dengan basa dalam asam tertentu. Dengan kata lain, kebasaan senyawa adalah jumlah ion hidrogen yang dapat bereaksi sepenuhnya dengan ion hidroksida yang dilepaskan oleh basa.
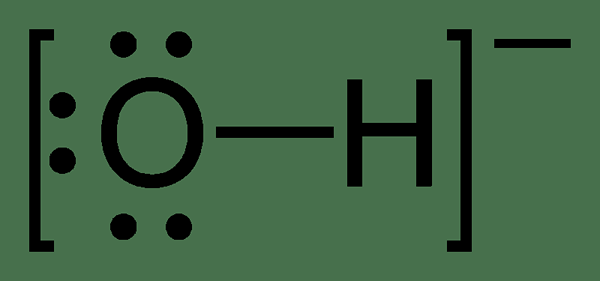
Gambar 02: Struktur kimia ion hidroksida
Faktor -faktor yang dapat mempengaruhi kebesaran suatu senyawa tercantum di bawah ini.
- Elektronegativitas
- Radius atom
- Biaya formal
Elektronegativitas atom mengacu pada afinitasnya terhadap elektron. Atom yang memiliki elektronegativitas tinggi dapat menarik elektron jika dibandingkan dengan atom elektronegatif yang rendah. Lebih tinggi electronegativity, menurunkan basa. Untuk melepaskan ion hidroksida, elektron ikatan antara atom oksigen dan sisa molekul harus sepenuhnya tertarik oleh atom oksigen (atom oksigen dalam kelompok hidroksida harus lebih elektronegatif daripada atom lainnya yang terikat) untuk). Contoh: Jika kebasaan ROH tinggi, elektronegativitas R lebih kecil dari atom oksigen.

Gambar 03: Sabun adalah basa lemah yang dibentuk oleh reaksi asam lemak dengan natrium hidroksida atau kalium hidroksida.
Jari -jari atom adalah faktor lain yang mempengaruhi kebasaan senyawa. Jika jari -jari atom kecil, kepadatan elektron atom itu tinggi. Oleh karena itu, ion hidroksida dapat dengan mudah dilepaskan. Maka kebencian senyawa itu relatif tinggi.
Biaya formal umumnya muatan positif atau muatan negatif. Muatan formal positif menunjukkan kepadatan elektron yang lebih sedikit. Oleh karena itu, elektron ikatan tidak dapat sepenuhnya tertarik oleh ion hidroksida. Maka tidak dapat dengan mudah dilepaskan (ion hidroksida), menunjukkan rasa basa yang lebih rendah. Sebaliknya, muatan formal negatif menyebabkan kebencian yang lebih tinggi.
Apa perbedaan antara keasaman dan kebasa?
Keasaman vs Basa | |
| Keasaman adalah kadar asam dalam zat. | Basilisitas mengacu pada keadaan menjadi basis, yang dapat melepaskan ion hidroksida (OH-). |
| ph | |
| Keasaman menyebabkan pH rendah dalam media berair. | Basity menyebabkan pH tinggi di media berair. |
| Ion | |
| Keasaman menunjukkan konsentrasi tinggi ion hidrogen dalam suatu media. | Basilisitas menunjukkan konsentrasi tinggi ion hidroksida dalam medium. |
| Tren berkala | |
| Keasaman meningkat dari kiri ke kanan periode dan ke bawah kelompok. | Kebasaan berkurang dari kiri ke kanan periode dan ke bawah kelompok. |
| Efek elektronegativitas | |
| Keasaman tinggi jika elektronegativitas (atom yang terikat atom hidrogen) tinggi. | Basilisitas tinggi jika elektronegativitas (atom tempat atom oksigen ion hidroksida terikat) rendah. |
Ringkasan - Keasaman vs Basa
Keasaman dan kebasaan adalah dua istilah mendasar yang digunakan dalam kimia. Keasaman disebabkan oleh senyawa asam. Basisity disebabkan oleh senyawa dasar. Perbedaan utama antara keasaman dan kebusukan adalah bahwa keasaman menyebabkan pH rendah sedangkan basilitas menyebabkan pH tinggi dalam medium berair.
Referensi:
1. “7.3: Efek Struktural pada Keasaman dan Basa.”Libretexts Chemistry, Libretexts, 7 September. 2016, tersedia di sini.
2. “Tren Tabel Berkala.”Jaringan Dokter Siswa, Tersedia Di Sini.
Gambar milik:
1. "Lemon-edit1" oleh André Karwath alias alias-karya sendiri (CC BY-SA 2.5) Via Commons Wikimedia
2. “Hydroxide-Lone-Pairs-2D” (domain publik) via Commons Wikimedia
3. “589824” (CC0) via Pixabay


