Perbedaan antara enzim dan koenzim
Perbedaan utama - enzim vs koenzim
Reaksi kimia mengubah satu atau lebih substrat menjadi produk. Reaksi ini dikatalisis oleh protein khusus yang disebut enzim. Enzim bertindak sebagai katalis untuk sebagian besar reaksi tanpa dikonsumsi. Enzim terbuat dari asam amino dan memiliki urutan asam amino unik yang terdiri dari 20 asam amino yang berbeda. Enzim didukung oleh molekul organik non-protein yang disebut kofaktor. Coenzymes adalah salah satu jenis kofaktor yang membantu enzim untuk melakukan katalisis. Perbedaan utama antara enzim dan koenzim adalah bahwa Enzim adalah protein yang mengkatalisasi reaksi biokimia ketika Coenzyme adalah molekul organik non-protein yang membantu enzim untuk mengaktifkan dan mengkatalisasi reaksi kimia. Enzim adalah makromolekul sedangkan koenzim adalah molekul kecil.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu enzim
3. Apa itu koenzim
4. Perbandingan berdampingan - enzim vs koenzim
5. Ringkasan
Apa itu enzim?
Enzim adalah katalis biologis dari sel hidup. Mereka adalah protein yang terdiri dari ratusan hingga jutaan asam amino yang terpasang bersama -sama seperti mutiara pada string. Setiap enzim memiliki urutan asam amino yang unik, dan ditentukan oleh gen tertentu. Enzim mempercepat hampir semua reaksi biokimia dalam organisme hidup. Enzim hanya mempengaruhi laju reaksi, dan kehadirannya sangat penting untuk memulai konversi kimia karena energi aktivasi reaksi diturunkan oleh enzim. Enzim mengubah laju reaksi tanpa dikonsumsi atau tanpa mengubah struktur kimia. Enzim yang sama dapat mengkatalisasi konversi substrat yang semakin banyak menjadi produk dengan menunjukkan kemampuan untuk mengkatalisasi reaksi yang sama berulang kali.
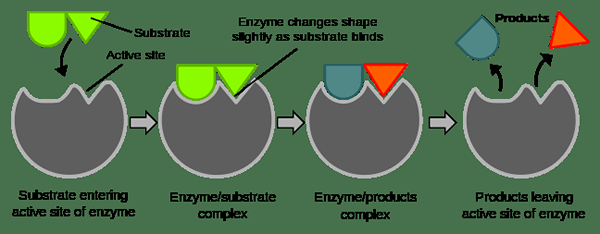
Enzim sangat spesifik. Enzim tertentu mengikat dengan substrat spesifik dan mengkatalisasi reaksi tertentu. Spesifisitas enzim disebabkan oleh bentuk enzim. Setiap enzim memiliki situs aktif dengan bentuk dan kelompok fungsional spesifik untuk pengikatan tertentu. Hanya substrat spesifik yang cocok dengan bentuk situs aktif dan mengikatnya. Spesifisitas pengikatan substrat enzim dapat dijelaskan oleh dua hipotesis bernama LOCK dan hipotesis utama dan diinduksi hipotesis FIT. Hipotesis kunci dan kunci menunjukkan kecocokan antara enzim dan substrat spesifik mirip dengan kunci dan kunci. Hipotesis Fit yang diinduksi mengatakan bahwa bentuk situs aktif dapat berubah agar sesuai dengan bentuk substrat spesifik yang mirip dengan sarung tangan yang sesuai dengan tangan seseorang.
Reaksi enzimatik dipengaruhi oleh beberapa faktor seperti pH, suhu, dll. Setiap enzim memiliki nilai suhu optimal dan nilai pH untuk bekerja secara efisien. Enzim juga berinteraksi dengan kofaktor non-protein seperti kelompok prostetik, koenzim, aktivator, dll. untuk mengkatalisasi reaksi biokimia. Enzim dapat dihancurkan pada suhu tinggi atau dengan keasaman tinggi atau alkalinitas karena mereka adalah protein.

Gambar 01: Model Fit yang diinduksi dari aktivitas enzim.
Apa itu koenzim?
Reaksi kimia dibantu oleh molekul non-protein yang disebut kofaktor. Kofaktor membantu enzim untuk mengkatalisasi reaksi kimia. Ada berbagai jenis kofaktor dan koenzim adalah satu jenis di antara mereka. Coenzyme adalah molekul organik yang digabungkan dengan kompleks substrat enzim dan membantu proses katalisis reaksi. Mereka juga dikenal sebagai molekul pembantu. Mereka terdiri dari vitamin atau berasal dari vitamin. Oleh karena itu, diet harus mengandung vitamin yang menyediakan koenzim penting untuk reaksi biokimia.
Coenzymes dapat mengikat dengan situs aktif enzim. Mereka mengikat secara longgar dengan enzim dan membantu reaksi kimia dengan menyediakan kelompok fungsional yang diperlukan untuk reaksi atau dengan mengubah konformasi struktural enzim. Oleh karena itu, pengikatan substrat menjadi mudah, dan reaksi mendorong produk. Beberapa koenzim bertindak sebagai substrat sekunder dan menjadi diubah secara kimia pada akhir reaksi, tidak seperti enzim.
Koenzim tidak dapat mengkatalisasi reaksi kimia tanpa enzim. Mereka membantu enzim untuk menjadi aktif dan menjalankan fungsinya. Setelah koenzim berikatan dengan apoenzim, enzim menjadi bentuk aktif dari enzim yang disebut holoenzyme dan memulai reaksi.
Contoh koenzim adalah adenosine triphosphate (ATP), nicotinamide adenine dinucleotide (NAD), flavin adenine dinucleotide (FAD), koenzim A, vitamin B1, B2, dan B6, dll.
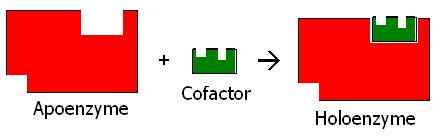
Gambar 02: Ikatan kofaktor dengan apoenzim
Apa perbedaan antara enzim dan koenzim?
Enzim vs koenzim | |
| Enzim adalah katalis biologis yang mempercepat reaksi kimia. | Koenzim adalah molekul organik yang membantu enzim untuk mengkatalisasi reaksi kimia. |
| Tipe molekuler | |
| Semua enzim adalah protein. | Coenzim adalah non-protein. |
| Perubahan karena reaksi | |
| Enzim tidak diubah karena reaksi kimianya. | Koenzim menjadi diubah secara kimia sebagai akibat dari reaksi. |
| Kekhususan | |
| Enzim spesifik. | Koenzim tidak spesifik. |
| Ukuran | |
| Enzim adalah molekul yang lebih besar. | Koenzim adalah molekul yang lebih kecil. |
| Contoh | |
| Amilase, proteinase, dan kinase adalah contoh enzim. | NAD, ATP, Coenzyme A, dan FAD adalah contoh koenzim. |
Ringkasan -Enzim vs Coenzyme
Enzim mengkatalisasi reaksi kimia. Coenzymes membantu enzim untuk mengkatalisasi reaksi dengan mengaktifkan enzim dan menyediakan gugus fungsional. Enzim adalah protein yang terdiri dari asam amino. Koenzim bukan protein. Mereka terutama berasal dari vitamin. Ini adalah perbedaan antara enzim dan koenzim.
Referensi:
1. “Enzim.”RSC. N.P., N.D. Web. 15 Mei 2017. .
2. “Biokimia struktural/enzim/koenzim.”Biokimia Struktural/Enzim/Coenzymes - Wikibooks, Buku Terbuka untuk Dunia Terbuka. N.P., N.D. Web. 15 Mei 2017. .
Gambar milik:
1. "Diagram Fit yang Diinduksi" oleh dibuat oleh timvickers, diveksia oleh fvasconcellos - disediakan oleh timvickers (domain publik) melalui commons wikimedia
2. "Enzim" oleh Moniquepena - karya sendiri (domain publik) melalui Commons Wikimedia


