Perbedaan antara setengah titik kesetaraan dan titik kesetaraan
Itu perbedaan utama antara setengah titik kesetaraan dan titik kesetaraan adalah itu Titik kesetaraan setengah adalah titik tengah antara titik awal dan titik kesetaraan titrasi tertentu sedangkan titik kesetaraan adalah di mana reaksi kimia berakhir.
Titrasi adalah teknik analitik dalam kimia yang penting dalam menentukan konsentrasi yang tidak diketahui dari sampel yang diberikan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa titik kesetaraan
3. Apa titik kesetaraan setengah
4. Perbandingan Berdampingan - Titik Kesetaraan Setengah vs Titik Kesetaraan dalam Bentuk Tabel
5. Ringkasan
Apa titik kesetaraan setengah?
Titik kesetaraan setengah dari titrasi adalah setengah antara titik kesetaraan dan titik awal (asal). Pentingnya hal ini adalah bahwa pada titik ini, pH larutan analit sama dengan konstanta disosiasi atau pKa asam yang digunakan dalam titrasi. Titik kesetaraan setengah terjadi pada setengah volume titik kesetaraan pertama dari titrasi. Jika ada beberapa titik kesetaraan dalam titrasi, ada beberapa titik kesetaraan setengah yang sama dengan jumlah titik kesetaraan. Misalnya, titik kesetaraan babak kedua terjadi di titik tengah antara titik kesetaraan pertama dan kedua.
Apa titik kesetaraan?
Titik kesetaraan dalam titrasi adalah titik aktual di mana reaksi kimia yang diinginkan dalam campuran reaksi berakhir. Kami biasanya melakukan titrasi untuk menentukan konsentrasi suatu zat dalam cairan. Jika kita tahu zat tersebut, titran (larutan yang digunakan untuk menentukan konsentrasi komponen dalam campuran cair) yang memiliki konsentrasi yang diketahui dapat digunakan untuk bereaksi dengan analit. Di sini, kami menyebutnya sebagai solusi standar karena molaritas yang tepat diketahui.

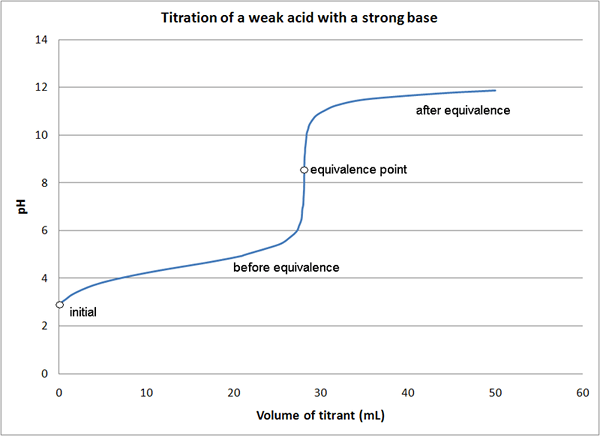
Gambar 01: Kurva titrasi yang menunjukkan titik kesetaraan
Dalam reaksi antara NaOH dan HCl, yang merupakan reaksi asam-basa, kita dapat menggunakan NaOH atau HCl sebagai titran yang memiliki konsentrasi yang diketahui. Di sini, titrant ditempatkan di burette, dan perlahan -lahan kita dapat menambahkannya ke titrand/analit sampai perubahan warna terjadi dalam campuran reaksi. Kita perlu menggunakan indikator karena NaOH dan HCl bukan indikator sendiri. Titik di mana perubahan warna terjadi adalah titik akhir dari titrasi, yang bukan titik kesetaraan reaksi.
Dalam titrasi ini, titik kesetaraan adalah titik di mana semua molekul HCl bereaksi dengan NaOH (atau titik di mana semua molekul NaOH bereaksi dengan HCl). Maka mol titrant harus sama dengan mol analit yang tidak diketahui karena stoikiometri antara HCl dan NaOH adalah 1: 1. Ada berbagai metode untuk menentukan titik kesetaraan titrasi.
- Perubahan warna indikator diri - Dalam reaksi yang melibatkan indikator sendiri sebagai reaktan, perubahan warna mengungkapkan titik kesetaraan titrasi karena mereka tidak menggunakan indikator.
- Titik akhir- Terkadang, titik kesetaraan dapat diambil sebagai titik akhir karena mereka kira -kira sama.
- Konduktansi- Dalam metode ini, konduktansi diukur sepanjang titrasi, dan titik kesetaraan adalah di mana perubahan konduktansi yang cepat terjadi. Ini adalah metode yang agak sulit.
- Spektroskopi- Ini adalah metode yang cocok untuk campuran reaksi berwarna -warni. Titik kesetaraan ditentukan sesuai dengan perubahan cepat dalam panjang gelombang yang diserap oleh sampel.
Apa perbedaan antara setengah titik kesetaraan dan titik kesetaraan?
Titrasi adalah teknik analitik dalam kimia yang penting dalam menentukan konsentrasi yang tidak diketahui dari sampel yang diberikan. Perbedaan utama antara setengah titik kesetaraan dan titik kesetaraan adalah bahwa titik kesetaraan setengahnya adalah titik tengah antara titik awal dan titik kesetaraan dari titrasi tertentu sedangkan titik kesetaraan adalah di mana reaksi kimia berakhir.
Tabulasi di bawah ini merangkum perbedaan antara titik kesetaraan setengah dan titik kesetaraan.
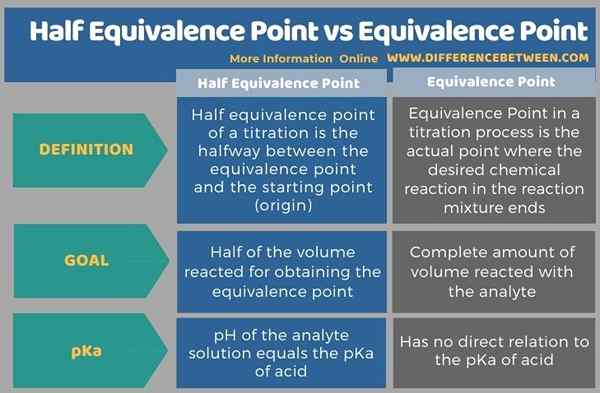
Ringkasan -titik kesetaraan setengah vs titik kesetaraan
Titrasi adalah teknik analitik dalam kimia yang penting dalam menentukan konsentrasi yang tidak diketahui dari sampel yang diberikan. Perbedaan utama antara setengah titik kesetaraan dan titik kesetaraan adalah bahwa titik kesetaraan setengahnya adalah titik tengah antara titik awal dan titik kesetaraan dari titrasi tertentu sedangkan titik kesetaraan adalah di mana reaksi kimia berakhir.
Referensi:
1. “Kurva Titrasi & Titik Kesetaraan (artikel)." Akademi Khan, Tersedia disini.
Gambar milik:
1. “Titrasi asam lemah dengan basa kuat” oleh Quantumkinetics - karya sendiri (CC dengan 3.0) Via Commons Wikimedia


