Perbedaan antara ikatan kimia yang terlokalisasi dan didelokalisasi
Itu perbedaan utama Antara ikatan kimia yang terlokalisasi dan didelokalisasi Ikatan kimia lokal itu adalah ikatan spesifik atau pasangan elektron tunggal pada atom spesifik sedangkan ikatan kimia yang didelokalisasi adalah ikatan spesifik yang tidak terkait dengan atom tunggal atau ikatan kovalen.
Ikatan kimia adalah hubungan antara dua atom. Koneksi ini terjadi karena tumpang tindih orbital molekul. Ada dua bentuk ikatan utama seperti ikatan kimia yang terlokalisasi dan didelokalisasi. Ikatan kimia lokal adalah tumpang tindih orbital molekul normal seperti ikatan sigma dan ikatan PI. Namun, ikatan kimia yang didelokalisasi berbeda. Obligasi ini terbentuk ketika beberapa ikatan lokal bercampur satu sama lain. Rincian lebih lanjut di bawah ini.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ikatan kimia lokal
3. Apa ikatan kimia yang didelokalisasi
4. Perbandingan berdampingan - ikatan kimia yang dilokalisasi vs yang dilokalisasi dalam bentuk tabel
5. Ringkasan
Apa itu ikatan kimia lokal?
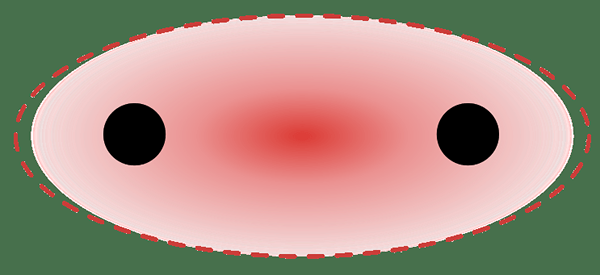
Ikatan kimia terlokalisasi adalah ikatan sigma dan pi normal atau pasangan elektron yang ada pada satu atom tunggal. Ikatan ini terkonsentrasi pada daerah terbatas dari suatu molekul. Daerah ini memiliki distribusi elektron terkonsentrasi. Dengan kata lain, kepadatan elektron wilayah ini sangat tinggi.

Gambar 01: ikatan sigma - ikatan kimia terlokalisasi
Ikatan lokal terbentuk ketika dua orbital molekul dari dua atom terpisah tumpang tindih satu sama lain. Obligasi sigma dapat terbentuk karena tumpang tindih dua orbital S, dua orbital P atau tumpang tindih S-P.
Apa ikatan kimia yang didelokalisasi?
Ikatan kimia yang didelokalisasi adalah ikatan kimia yang tidak terkait dengan hanya satu atom tetapi dengan beberapa atom atau ikatan kimia lainnya. Kami menyebut elektron dalam ikatan ini sebagai 'elektron yang didelokalisasi'. Delokalisasi terjadi dalam sistem PI terkonjugasi. Sistem PI terkonjugasi memiliki ikatan rangkap dan ikatan tunggal dalam pola bergantian.
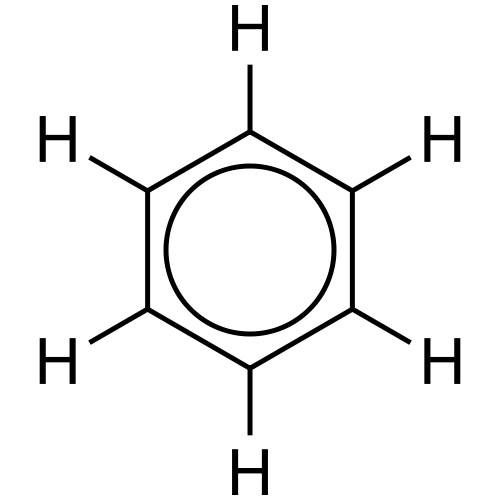
Gambar 02: Delokalisasi elektron
Misalnya, cincin benzena memiliki tiga ikatan tunggal dan tiga ikatan rangkap dalam pola bergantian. Setiap atom karbon dalam cincin ini memiliki orbital P yang tidak mengalami tumpang tindih frontal. Oleh karena itu orbital p ini dapat memiliki sisi tumpang tindih. Jenis yang tumpang tindih ini adalah delokalisasi. Kita dapat menunjukkan ini sebagai dua lingkaran di bagian atas cincin benzena dan bagian bawah cincin. Elektron ini bebas bergerak di seluruh molekul karena mereka tidak memiliki ikatan permanen dengan satu atom atau ikatan kovalen.
Apa perbedaan antara ikatan kimia yang terlokalisasi dan didelokalisasi?
Ikatan kimia lokal adalah ikatan sigma dan pi normal atau pasangan elektron tunggal yang ada pada satu atom tunggal. Obligasi ini terbentuk karena tumpang tindih frontal antara orbital S, orbital p atau orbital S dan P. Selain itu, elektron -elektron ini terbatas pada wilayah tertentu antara dua atom yang terpisah. Ikatan kimia yang didelokalisasi adalah ikatan kimia yang tidak terkait dengan hanya satu atom tetapi dengan beberapa atom atau ikatan kimia lainnya. Ikatan ini memiliki elektron yang tersebar di seluruh molekul yang bebas bergerak. Obligasi ini terbentuk karena sisi tumpang tindih orbital P. Ini adalah perbedaan utama antara ikatan kimia yang terlokalisasi dan didelokalisasi.
Ringkasan -ikatan kimia yang terlokalisasi vs
Ikatan kimia adalah hubungan antara dua atom. Ada dua bentuk ikatan kimia seperti ikatan kimia yang terlokalisasi dan didelokalisasi. Perbedaan antara ikatan kimia yang terlokalisasi dan didelokalisasi adalah bahwa ikatan kimia lokal adalah ikatan spesifik atau pasangan elektron tunggal pada atom spesifik sedangkan ikatan kimia yang didelokalisasi adalah ikatan spesifik yang tidak terkait dengan atom tunggal atau ikatan kovalen.
Referensi:
1. Libretexts. “Delokalisasi elektron.”Kimia Libretexts, Libretexts, 20 Desember. 2016. Tersedia disini
2. “Orbital molekul terlokalisasi.”Wikipedia, Wikimedia Foundation, 19 Juni 2018. Tersedia disini
Gambar milik:
1.'Sigma Bond'by SVG: Zoofari; Raster: Anselm H. C. Horn (CC BY-SA 3.0) Via Commons Wikimedia
2.'Benzene-6H-Delocalized'By elit-karya sendiri, (cc by-sa 3.0) Via Commons Wikimedia


